Приведен литературный обзор первых работ по получению ферратов. Показано, что ферраты могут быть получены тремя основными группами методов: высокотемпературным окислением, химическим окислением и электрохимическим окислением. Для промышленного получения феррата, предпочтительным является способ электрохимического окисления железа, отличающийся высокой экологичностью, простотой, надежностью и безопасностью.
Ключевые слова: ферраты, степень окисления, реагенты-окислители, электрохимическое окисление, высокотемпературное окисление.
В настоящее время в технологиях водоподготовки и очистки сточных вод широкое применение нашли реагенты-окислители. Одним из наиболее активных реагентов-окислителей является феррат натрия. Феррат натрия обладает окислительным потенциалом, превышающим окислительный потенциал озона. Его окислительный потенциал является наибольшим в ряду потенциалов реагентов-окислителей, используемых в настоящее время. Внедрение в практику очистки природных и сточных вод ферратов в настоящее время препятствует отсутствие экологически безопасных, простых и надежных технологий, позволяющих получить эти реагенты окислители в промышленных масштабах.
Феррат калия впервые был описан французским ученым Фреми в 1841 г. [1]. Фреми исходил из предположения, что у железа могут быть соединения со степенью окисления более высокой, чем обычная +3, по аналогии с марганцем, для которого к тому времени уже были известны манганаты и перманганаты. В своих исследованиях он использовал методы, которые, по его мнению, должны были привести к получению таких соединений железа.
В своих работах [1–3] Фреми описал несколько методов получения феррата калия, которые он отнес к двум группам:
- высокотемпературное окисление оксида железа(III) и железа в твердом виде («сухой способ» в терминологии Фреми);
- химическое окисление гидроксида железа(III) в щелочных растворах («мокрый способ»).
Для высокотемпературного окисления Фреми описал четыре варианта проведения процесса:
1) взаимодействие оксида железа(Ш) с оксидом калия в токе воздуха или, лучше, кислорода:
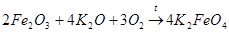 ; (1)
; (1)
2) взаимодействие оксида железа(Ш) с пероксидом калия также в присутствии воздуха или кислорода:
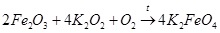 ; (2)
; (2)
3) взаимодействие оксида железа(Ш) с оксидом калия и нитратом калия:
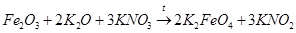 (3)
(3)
4) взаимодействие металлического железа с нитратом калия:
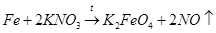 (4)
(4)
Проведя синтез по варианту 1, Фреми предположил, что эта реакция идет через пероксид калия. Поэтому далее он получил пероксид калия, провел синтез по варианту 2 и нашел, что в этом случае процесс идет лучше.
Вариант 3 отличается от варианта 1, по существу, только тем, что источником кислорода является нитрат калия, и процесс также идет лучше, чем по первому варианту, вероятно, потому, что не надо подавать кислород извне.
Предложив вначале три варианта высокотемпературного окисления [1], немного позже Фреми добавил к ним еще один [2], причем считал его наилучшим, поскольку синтез по вариантам 1–3 не всегда проходил успешно [3].
Следует отметить, что в то время химикам уже была известна реакция взаимодействия железа с нитратом калия, дающая оксид железа (III) (с выделением тепла, обычно со взрывом):
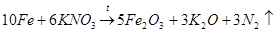 (5)
(5)
Фреми предположил, что при действии на образующийся оксид железа(III) оксида калия и кислорода может получаться феррат калия (как в варианте 1):
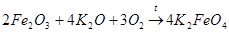 (6)
(6)
Фреми удалось подобрать условия, чтобы получить именно феррат калия. Для этого он нагревал железные опилки до красного каления, а потом добавлял к ним в нужной пропорции высушенный и мелко растертый нитрат калия.
По-видимому, механизм реакции взаимодействия железа и нитрата калия не такой, как предполагал Фреми (с выделением N0, что у него не было отмечено), но для получения феррата калия это не имеет значения.
Ферраты достаточно легко распознаются по характерной окраске — темные красно-фиолетовые кристаллы, соответствующую окраску имеют и растворы.
Другими учеными была описана реакция оксида железа (III) с нитратом калия без оксида калия, что следует считать модификацией варианта 3 [4, 5] (вероятная схема процесса, протекающего с выделением газа):
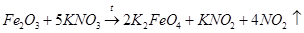 (7)
(7)
Для низкотемпературного химического окисления Фреми предложил «мокрый способ» — действие газообразного хлора на суспензию гидроксида железа (III) в концентрированном растворе гидроксида калия, по аналогии с уже известным в то время процессом получения перманганата [1–3]:
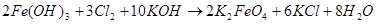 (8)
(8)
Процесс, по мнению Фреми, идет через гипохлорит калия [2]:
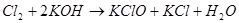 (9)
(9)
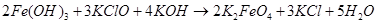 (10)
(10)
Если гидроксид калия взят в избытке, происходит осаждение феррата калия. Для получения чистого продукта Фреми растворял феррат калия в воде и осаждал его концентрированным раствором гидроксида калия [3].
Кроме того, Фреми получил феррат натрия химическим окислением, однако ему не удалось осадить его в твердом виде из-за более высокой растворимости этой соли. Получить феррат натрия высокотемпературным окислением по 4-му варианту ему не удалось из-за меньшей реакционной способности нитрата натрия. Также им были получены некоторые другие соли обменными реакциями с ферратом калия [3].
Дополнительно можно отметить, что позже был получен феррат натрия действием пероксида натрия на железо в воздухе, процесс в этом случае, скорее всего, идет через оксид железа(Ш), т. е. по варианту 2 высокотемпературного окисления [6].
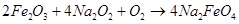 (11)
(11)
В том же 1841 г. немецкий ученый Поггендорф (знакомый с работой Фреми [1]) предложил принципиально иной метод получения ферратов — электрохимическое окисление [7] (что считают третьей группой методов). Он проводил эксперименты, в которых использовал гальваническую цепь, включающую платиновую пластину, погруженную в раствор азотной кислоты (катод), и пластины из различных материалов, погруженные в концентрированный раствор гидроксида калия (анод). Для ряда материалов на аноде просто наблюдалось выделение кислорода (графит, платина, никель и др.), Для других этот процесс сопровождался окислением материала анода — потускнением и образованием покрытия на его поверхности (серебро, медь, сурьма и др.). И только чугун растворялся, давая раствор с характерной винно-красной окраской (с попутным выделением кислорода). Из полученного раствора со временем выпадал осадок оксида железа(Ш). По этим признакам Поггендорф сделал вывод, что в данном случае идет процесс окисления железа с образованием феррата калия.
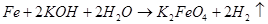 (12)
(12)
При этом процесс получения феррата калия шел только для двух видов чугуна, с которыми он работал. Еще один вид чугуна давал незначительное количество этого продукта, а другой не давал его вообще. Обычная сталь того времени также давала незначительное количество феррата калия, а кованое железо (самое чистое железо того времени) не давало вообще. Сила тока в этих случаях имела близкое значение, и Поггендорф объяснил это явление присутствием в реагирующем чугуне частиц углерода. Он считал, что этот способ синтеза лучше предложенных Фреми, однако не выделил феррат калия в осажденном виде.
Фреми также показал, что оксид железа, соответствующий железной кислоте, имеет формулу FеОз [3]. Его метод анализа включал термическое разложение феррата калия в растворе, определение количества выделившегося кислорода и количества выпавшего в осадок оксида железа(Ш) (состав которого в то время был уже известен). Сопоставление этих количеств подтвердило формулу FеОз.
Независимо от Фреми подобный анализ с теми же результатами выполнил Смит [4], причем он использовал феррат калия, полученный высокотемпературным окислением.
Другой метод анализа использовал Розе [8]. Он включал восстановление в растворе феррата калия, полученного электрохимическим окислением, газообразным диоксидом серы до оксида железа(Ш), отделение выпавшего осадка (и удаление остатков газа) и осаждение из раствора образовавшегося сульфата добавлением хлорида бария. Количество полученного сульфата бария было пропорционально количеству кислорода, высвободившегося из феррата калия. Сопоставление количества оксида железа(Ш) и количества сульфата бария также подтвердило формулу FеОз.
Эти исследования показали, что при всех указанных способах получения феррата калия образуется один и тот же продукт.
Долгое время ферраты оставались чисто лабораторными продуктам, которые исследователи получали сами. Ситуация изменилась только после 1950 г., когда был предложен метод химического окисления, в котором вместо хлора использовали гипохлорит натрия (как было указано, еще Фреми предполагал, что окисление хлором идет через гипохлорит [2]):
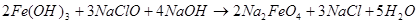 (13)
(13)
Согласно первоначальному варианту [9], к щелочному раствору гипохлорита натрия добавляли пасту гидроксида железа(Ш), полученную из хлорида железа(Ш) и гидроксида натрия в воде. Процесс проводили при 50–55°С с добавлением твердого гидроксида натрия. Продукт высаждали в виде феррата калия (эта соль менее растворима) твердым гидроксидом калия при охлаждении и переосаждали из раствора гидроксида калия с промывкой этанолом. Этот лабораторный вариант давал выход до 15 %.
Согласно модифицированному варианту [10], к щелочному раствору гипохлорита натрия просто добавляли твердый нитрат железа(Ш), процесс проводили при 25–30°С с добавлением твердого гидроксида калия. Далее процесс вели подобно первоначальному варианту, выходом по основному продукту до 76 %.
Насколько нам известно, именно по этому методу было начато производство феррата калия, что сделало возможным его практическое применение [11].
На основании этой информации можно сделать вывод, что, по существу, еще Фреми и Поггендорф определили три основные группы методов получения ферратов, которые используются и в наше время:
химическое окисление соединений железа(II) и (III) в щелочных растворах; электрохимическое окисление железа в щелочных растворах; высокотемпературное окисление железа, соединений железа (II) и (III) в твердом виде.
Химическое окисление требует применения газообразного хлора или гипохлорита натрия, что неудобно с экологической точки зрения. Для реализации высокотемпературного окисления необходимы высокие температуры, а также твердые окислители, что делает этот процесс взрывоопасным.
Таким образом, проведенный обзор технологических процессов синтеза высокоэффективных реагентов-окислителей позволяет сделать вывод, что предпочтительным методом промышленного получения ферратов является электрическое окисление металлического железа в щелочной среде.
Литература:
1. Fremy, E. Recherches sur faction des peroxides alcalins sur les oxides metalliques / E. Fremy // Compt. Rend. Acad. Sci. 1841. 12, 23–24.
2. Fremy, E. Recherches sur les acides metalliques / E. Fremy // Compt. Rend. Acad. Sci.1842, 14,442–446.
3. Fremy, E. Recherches sur les acides metalliques / E. Fremy // Ann. Chim. Phys. 1844, 12,361–382.
4. Smith, J. D. On the composition of an acid oxide of iron (ferric acid) / J. D. Smith // Phil. Mag. 1843,23,217–225.
5. Wittstein, G. C. Beitrag zur Bildung und Darstellung der Eisensaure / G.C Wittstein // Repertor. Pharm. 1845, 89 (39), 176–179.
6. Wallace, T. Some properties of fused sodium hydroxide / T. Wallace, A. Fleck // J. Chem. Soc. Trans. 1921, 119, 1839–1860.
7. Poggendorff, J. С Ueber die Frage, ob es wirksame galvanische Ketten ohne primitive chemische Action gebe, und uber die Bildung der Eisensaure auf galvanischem Wege / J. С Poggendorff//Ann. Phys. Chem. 1841, 130 (54), 353–377.
8. Rose H. Ueber die Zusammensetzung der Eisensaure / H. Rose // Ann. Phys. Chem. 1843, 135 (59), 315–325.
9. Hrostowski, H. J. The magnetic susceptibility of potassium ferrate / H. J. Hrostowski, A. B. Scott//J. Chem. Phys. 1950, 18, 105–107.
10. Thompson, G. W. Preparation and purification of potassium ferrate VI / G. W. Thompson, L. T. Ockerman, J. M. Schreyer// J. Amer. Chem. Soc. 1951,73,1379–1381.
11. Андреев, СЮ. Интенсификация очистки производственных сточных вод с использованием окислителя на основе феррата натрия / СЮ. Андреев, И. А. Гарькина, Н. Н. Ласьков, В. А. Князев // Региональная архитектура и строительство. — 2014. -№ 2.-С. 152–156.







