В статье рассматривается метод электрохимического извлечения марганца из водных растворов. Суть метода заключается в электрообработке хлоридсодержащих растворов, при этом образуется молекулярный хлор, который взаимодействуя с водой, образует активные формы хлорсодержащих окислителей. Далее, при контакте окислителя с ионами марганца протекает процесс его осаждения в виде дисперсной фазы.
Ключевые слова: растворы, марганец, осаждение, параметры, процесс.
Анализ существующих методов извлечения Mn (II) из техногенных водоемов показал, учитывая при высоких концентрациях хлорид-ионов в растворе (более 600 мг/дм3), наиболее рационально извлекать марганец путем переведения ионов Mn2+ под действием окислителя — «активного хлора» — в нерастворимые формы Mn3+ и Mn4+ и последующего извлечения скоагулированного осадка электрофлотационным способом.
Сущность применяемого метода заключается в следующем: при электрообработке хлоридсодержащих растворов, образуется молекулярный хлор, который взаимодействуя с водой, образует активные формы хлорсодержащих окислителей, так называемый «активный хлор» [8, 13]. Далее, при контакте «активного хлора» с ионами Mn2+ протекает окислительно-восстановительный процесс в ходе, которого двухвалентный марганец окисляется до нерастворимых форм Mn3+ и Mn4+:
2Cl- — 2e → Cl2,
Cl2 + H2O → H+ + Cl- + HClO,
Мn2+ + НСlО + Н+ → Сl− + Мn3+ + Н2О.
Анализ опыта использования «активного хлора» в качестве окислителя при окислении переходных металлов показал, что окислительно-восстановительный процесс протекает под действием атомарного кислорода, образующегося при восстановлении «активного хлора» ионами Mn2+. Причем ионы Mn2+ в окислительной системе выступают не только как восстановители, но и как катализаторы процесса, что значительно ускоряет время протекания реакции [9, 12]:
Mn2+
НСlО → НСl + О•
Выбор электрофлотационного метода для извлечения образующегося марганецсодержащего осадка обусловлен отличительными особенностями извлекаемых катионов марганца, а именно: хрупкостью коллоидных хлопьев марганца, способностью к передиспергированию при интенсивном перемешивании суспензии, необходимостью проведения флотации при низкой скорости газового потока [1, 2, 6, 14]. С этой точки зрения электрофлотационный процесс, отличающийся высокой степенью дисперсности выделяющихся пузырьков, отсутствием в аппаратах движущихся частей, а так же возможностью плавного регулирования скорости изменения степени насыщения пульпы газовыми пузырьками, имеет явные преимущества по сравнению с другими флотационными методами извлечения металлсодержащих осадков [3, 10]. Кроме того, сочетания процессов осаждение — флотация позволяет достигать высоких показателей извлечения Mn из растворов в виде продукции [7, 8].
В первой камере аппарата протекает процесс окисления Mn2+ в Mn3+ и Mn4+ и последующего электрокоагуляционного осаждения соединений марганца. Во второй камере аппарата осуществляли процесс электрофлотационного извлечения дисперсной фазы марганца из водных растворов.
При проведении исследований было установлено, что в первой камере аппарата полное извлечение ионов Mn2+ из раствора в процессе окислительного осаждения наблюдается в интервале рН системы от 4,5 до 10,5. Однако следует учесть, что при электролизе хлоридсодержащих растворов на аноде возможно образование несколько активных формы хлорсодержащих окислителей: Сl2, НСlО, СlО–, окислительная активность которых будет зависеть от рН растворов. Максимальная окислительная активность характерна для хлорноватистой кислоты (НСlО), накопление которой наблюдается в диапазоне рН 3,5–7,5, т. е. в слабокислой и нейтральной областях [13]. Следовательно, исходя из интервала рН, при котором возможно образование дисперсной фазы марганца, а так же учитывая окислительную активность, образующихся хлорсодержащих соединений процесс окислительного осаждения Mn (II) рекомендуется осуществлять в диапазоне рН от 4,5 до 7,5.
При исследовании кинетики протекания процесса окислительного осаждения ионов Mn2+ были рассмотрены два способа контакта окислителя с марганецсодержащим растворов — электрокоагуляционный и реагентный. В случае реагентного осаждения Mn (II) раствор окислителя предварительно получали в электролизере путем электрообработки растворов NaCl, и далее полученный раствор «активного хлора» вводили в водную систему, содержащую ионы Mn2+. В случае электрокоагуляционного осаждения Mn (II) в раствор, содержащий ионы Mn2+, предварительно вводили хлорид-ионы в виде раствора NaCl и затем проводили электролиз всей системы (при аналогичных первому случаю параметрах работы электролизера).
Полученные кинетические зависимости показали, что максимальное извлечение марганца в виде дисперсной фазы в случае реагентного осаждения наблюдаются после 5 минут, тогда как в случае электрокоагуляции после 1 минуты. То есть при электрокоагуляционном извлечении скорость протекания процесса возрастет в 5 раз.
Данный факт объясняться тем, что в случае электрокоагуляционного извлечения Mn (II) окислительно-восстановительный процесс протекает при участии суммы окислителей таких как НСlО, О∙, СlО∙, Сl∙, ОН∙, Н∙, которые из-за своей термодинамической неустойчивости мгновенно вступают в реакцию с ионами Mn2+, что в итоге приводит к значительному сокращению времени протекания процесса [4, 5]. Кроме того, в данном случае процесс окисления протекает во всем объеме обрабатываемого раствора, причем, выделяющиеся на электродах пузырьки газа способствуют равномерному распределению окислителя по всему объему реакционной смеси без использования перемешивающих устройств, что значительно интенсифицирует процесс окисления.
При этом, электрообработка образующейся коллоидной системы интенсифицирует коагуляционный процесс [4]. Так, в ходе выполнения экспериментов отмечено, что начало образования четкой верхней границы слоя осадка в случае реагентного осаждения Mn (II) электролизными растворами «активного хлора» наблюдается после 18 минут с момента начала хлопьеобразования, тогда как при электрокоагуляционном осаждении это отмечалось уже после 1,5 минут. Таким образом, полученные результаты показали, что электрокоагуляционный способ извлечения Mn (II) является более приоритетным по сравнению с реагентным.
Экспериментальные исследования оптимальных параметров работы электролизера при электрокоагуляционном извлечении Mn (II) позволили установить, что процесс электрокоагуляции в диапазоне рН 4,5–7,5 при электрообработке в течении 1 минуты более рационально проводить при концентрации ионов Cl− в растворе не менее 600 мг/дм3 и плотности тока на анодах 300 А/м2.
Экспериментальные исследования процесса электрофлотационного извлечения дисперсной фазы Mn (III,IV), протекающего во второй камере аппарата, показали что, максимальное извлечение осадка из растворов (до 98,9 %) наблюдаются в интервале рН 4,5 − 8,0. Оценка влияния на процесс флотации токовой нагрузки подаваемой на электроды, показала, что в диапазоне плотностей тока на катодах (Isк) 80 − 100 А/м2 после десяти минут проведения процесса электрофлотации наблюдается максимальное извлечение дисперсной фазы марганца — 98,9 % (рис. 1) [2].
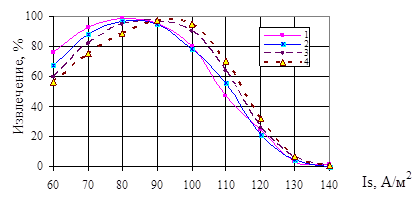
Рис. 1. Извлечение дисперсной фазы марганца из растворов, при разных концентрациях Mn(II): 1 — Сисх Mn2+ = 50 мг/дм3; 2 — Сисх Mn2+ = 100 мг/дм3; 3 — СисхMn2+ =150 мг/дм3; 4 — Сисх Mn2+ = 200 мг/дм3
Таким образом, проведенные исследования позволили установить технологические параметры извлечения Mn (II) из техногенных водоемов в виде кондиционного сырья:
- первая камера аппарата (процесс электрокоагуляции): рН = 4,5–7,5,
t = 1 мин., СCl− более 600 мг/дм3;
- вторая камера аппарата (процесс электрофлотации): рН 5,5 − 7,5, времени флотации 10 минут, плотности тока на катодах 80 − 100 А/м2.
Литература:
2. Колесников В. А. Электрофлотационный способ очистки сточных вод гальванических производств. ВСТ: Вод. и сан. техн. − Haustechn, 1997, № 8. — С. 10–11.
3. Краснобородько И.Г, Яковлев С. В. Технология электрохимической очистки воды. − Л.: Стройиздат, Ленингр. Отд-е, 1987. –312 с.
4. Лавров И. С. Влияние внешнего электрического поля на эффект электрофлотации // Жур. прикл. химии, 1977, Т.50, № 10. — С. 2252–2256.
5. Мапнев А. И. Очистка сточных вод флотацией. − Киев: Будивельник, 1976. — 132 с.
6. Матов Б. Электрофлотация. Кишенев: Картя Молдовескэ, 1971. — 184 с.
7. Мишурина О. А. Электрофлотационное извлечение марганца из гидротехногенных ресурсов горных предприятий // Вестник Магнитогорского государственного технического университета им. Г. И. Носова. 2009. № 3. С. 72–74.
8. Мишурина О. А. Технология электрофлотационного извлечения марганца в комплексной переработке гидротехногенных георесурсов медноколчеданных месторождений. — автореферат диссертации на соискание ученой степени кандидата технических наук // Магнитогорский государственный технический университет им. Г. И. Носова. Магнитогорск, 2010.
9. Мишурина О. А., Муллина Э. Р. Химические закономерности процесса селективного извлечения марганца из техногенных вод // Вестник Магнитогорского государственного технического университета им. Г. И. Носова. 2012, № 3. С. 58–62.
10. Мишурина О. А., Муллина Э. Р. Технология электрохимической очистки сточных вод // Международный журнал прикладных и фундаментальных исследований. 2015. № 4–1. С. 29–31.
11. Мишурина О. А., Чупрова Л. В., Муллина Э. Р. Особенности химических способов извлечения марганца из технических растворов // Молодой учёный. — 2013. — № 5. — С.84–86.
12. Мишурина О. А., Чупрова Л. В., Муллина Э. Р. Деманганация сточных вод растворами хлорной извести // Альманах современной науки и образования. — 2013. — № 9 (76). — С.115–118.
13. Мишурина О. А., Чупрова Л. В., Муллина Э. Р. Химические превращения кислородсодержащих ионов хлора растворов при разных значениях диапазона рН // Международный журнал прикладных и фундаментальных исследований. 2014. № 2–2. С. 43–46.
14. Назарова Г. Н., Костина Л. В., Алексеева Р. К. К вопросу об очистке сточных вод электрофлотационным способом. // Сб. трудов ИОТТ «Проблемы обогащения твердых горючих ископаемых», 1972. Т.1, вып. 2. — М. — С. 19–29.







