Спектрофотометрическим методом изучена кинетика пероксидазного окисления гидрохинона перекисью водорода в зависимости от концентрации субстратов и рН растворов.
Установлено, что ферментативная реакция имеет первый порядок по перекиси водорода в диапазоне концентраций перекиси водорода 0,06–0,46 мМоль и несколько более — 1 при 1,0–3,0 мМоль. Это объясняется ингибированием ферментативной реакции высокими концентрациями перекиси водорода. Порядок ферментативной реакции по гидрохинону также близок к первому практически во всем диапазоне концентраций гидрохинона (0,2–1,5 мМоль).
В диапазоне рН 3,6–7,4 зависимость скоростей ферментативной реакции от концентрации перекиси водорода имеет первый порядок. При повышении рН скорость ферментативной реакции возрастает, и процесс каталитического окисления гидрохинона практически не зависит от рН вплоть до значений рН 8,0.
Оптимизирован состав субстратной смеси для осуществления реакции пероксидазного окисления гидрохинона перекисью водорода, пригодной для аналитических целей, который может быть представлен следующим соотношением компонентов:
Гидрохинон — 10–3–10–2 М
Перекись водорода — 10–3–5·10–3М
Сульфит натрия — 0,05–0,1М
рН — 7,5–8,5
Ключевые слова: пероксидаза хрена, перекись водорода, гидрохинон, пероксидазное окисление, кинетика, начальная скорость, константа Михаэлиса, бесконкурентное ингибирование.
Введение
Пероксидазный катализ находит все большее применение в аналитической практике для определения широкого круга веществ органической и неорганической природы, а также в хемо- и биосенсорике [1–4]. При этом выбор медиаторной реакции, катализируемой пероксидазой, играет чуть ли не решающую роль в построении аналитической системы.
Ранее нами была изучена реакция пероксидазного окисления иодид-ионов перекисью водорода с целью ее применения в электрохимических системах с амперометрической детекцией [5.6]. Очевидно, подобные предположения можно отнести и к другим электрохимически обратимым системам, например, ферро-ферри-цианид, хинон-гидрохинон и др. [7–9] Из перечисленных медиаторов система хинон-гидрохинон относится к быстро окисляемым обратимым реакциям, которую помимо потенциометрической регистрации можно наблюдать и с использованием фотографической детекции. [10,11]. Последнее обусловлено способностью гидрохинона и его производных участвовать в реакциях с галогенидами серебра, входящих в фоточувствительный слой преобразователя информации. [12,13]
Целью настоящего исследования является изучение закономерностей реакции окисления гидрохинона перекисью водорода в присутствии пероксидазы хрена.
Экспериментальная часть
Исходные вещества, рабочие растворы и оборудование
В работе использовали препараты пероксидазы хрена фирмы “Reanal” (Венгрия) с RZ = 0,6. При изучении механизма и кинетики пероксидазных реакций использовали пероксидазу НПО «Биолар» с RZ = 2,9–3,2 активностью 820 ед/мг.
Для определения точной концентрации пероксидазы измеряли оптическую плотность водного раствора пероксидазы при λ403 нм и с учетом коэффициента молярного поглощения рассчитывали концентрацию пероксидазы по эмпирической формуле: С = 0,44· А, где А — оптическая плотность раствора. Растворы с меньшей концентрацией пероксидазы готовили ежедневно разбавлением исходного раствора пероксидазы.
Перекись водорода, ос.ч. использовали без дополнительной очистки. Концентрацию перекиси водорода устанавливали еженедельно перманганатным методом [14]. Рабочие растворы перекиси водорода готовили разбавлением исходного раствора перекиси водорода бидистиллированной водой. Концентрацию полученных растворов контролировали также спектрофотометрически с учетом коэффициента молярного поглощения ε230 нм= 72,7 М-1см-1 [15].
Для приготовления буферных растворов применяли фиксаналы соответствующих веществ.
Раствор бензохинона для снятия спектров поглощения готовили растворением в теплой дистиллированой воде кристаллов дважды возоганного бензохинона.
Дистиллированная вода, используемая в работе имела удельную электроапроводность не более 0,2 мкСименс/см.
В работе использовали кварцевую, стеклянную и тефлоновую посуду, которую предварительно очищали концентрированной соляной и азотной кислотами (х.ч.) и тщательно промывали большими количествами деионизованной воды. Для приготовления эталонных растворов использовали мерную посуду 1 и 2 классов точности.
Отбор малых объемов жидкости (10–200 мкЛ) производили с помощью автоматических микродозаторов “Varipipette” (Польша) с погрешностью не более 2 %.
Оптическую плотность растворов измеряли во времени на спектрофотометрах СФ-46 (ЛОМО, Санкт-Петербург) и “Specord-UV-Vis”(Германия) с использованием кварцевой кюветы с l=10,0 мм. Фотометрическая точность приборов составляла ±1 % от величины оптической шкалы. Точность установки длины волны не менее ±0,3–0,4 нм. Запись спектров и кинетических кривых осуществляли на спектрофотометре “Specord-UV-Vis” с использованием «обзорного» масштаба.
Кинетику реакции ферментативного окисления гидрохинона с концентрацией последнего более 10–3 М изучали потенциометрически с использованием электрода ЭО-2 Гомельского ЗИП и ЭВЛ1-М3, подключенных к иономеру И-130. Измерение потенциала гальванической ячейки регистрировали автоматически на потенциометре КСП-4.
Методика эксперимента
Кинетику ферментативных реакций изучали по начальным скоростям индикаторной реакции [16].
Для этого в кварцевую кювету с l= 10,0 мм последовательно вносили 2,7 мл раствора гидрохинона (10–5–10–2 М) и пероксидазы в буфере с определенным значением рН и 0,3 мл перекиси водорода (0,02–0,2 мМоль) в том же буфере. Смесь быстро перемешивали и регистрировали изменение оптической плотности при максимуме поглощения бензохинона λ250 нм. [15]
Для учета фоновой реакции параллельно снимали кинетические характеристики реакции взаимодействия перекиси водорода и гидрохинона, взятых в тех же концентрациях, но в отсутствии фермента.
Скорость реакции характеризовали концентрацией образования бензохинона в единицу времени. Концентрацию веществ рассчитывали, использую значение коэффициентов молярного поглощения. Значения кажущихся констант Михаэлиса КМ и максимальную скорость реакции v находили графически путем получения зависимости начальной скорости реакции от концентрации субстрата, построенных в двойных обратных координатах Лайнуивера-Берка. [17].
Результаты и их обсуждение
На рисунке 1 приведены спектры поглощения водных растворов гидрохинона и бензохинона.
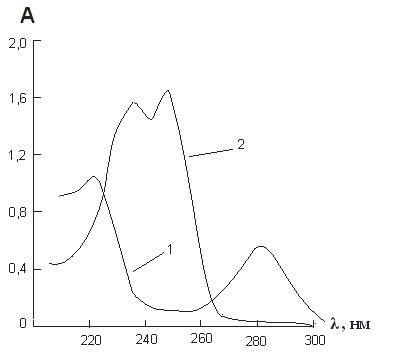
Рис. 1. Спектры поглощения гидрохинона (1) и бензохинона (2) в водных растворах
Если учесть реакции, протекающие в растворе
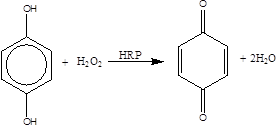
то за кинетикой реакции можно следить по скорости изменения концентрации бензохинона, которая может быть рассчитана по формуле:
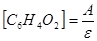 ,
,
где А — оптичесская плотность; ε- молярный коэффициент поглощения бензохинона при λ250 нм
Уменьшение концентрации перекиси водорода в фермент-субстратной смеси описывается уравнением
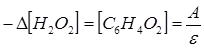
Приняв за скорость реакции отношение изменения оптической плотности за промежуток времени 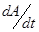 , правомерно записать:
, правомерно записать:
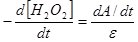
Однако, помимо ферментативной реакции идет и самопроизвольное окисление гидрохинона перекисью водорода, которое вносит свой вклад в изменение оптической плотности. Этот процесс может быть описан как:
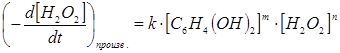
где k — константа скорости самопроизвольной реакции;
m и n — числовые коэффициенты, соответствующие порядку реакции.
Из литературных данных [18] следует, что m равен n и порядок неферментативной реакции соответствует двум.
Таким образом, пероксидазное окисление гидрохинона перекисью водорода следует рассматривать как суммарный процесс ферментативного и произвольного окисления гидрохинона:
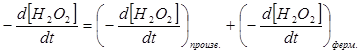
Или с учетом вышеприведенных значений имеем:
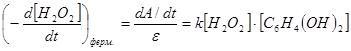
Выведенное уравнение для расчета начальных скоростей реакции позволяет теоретически оценить скорость ферментативной реакции и сравнить с экспериментальными значениями.
Предварительно нами получена зависимость линейного изменения оптической плотности от времени экспозиции ферментативной реакции и концентрации пероксидазы.
Установлено, что линейное изменение зависимости оптической плотности от времени протекания ферментативной реакции наблюдается в интервале 0,5–1,5 минуты при концентрации фермента 0,25–1,0 нМ (см. рис.2).
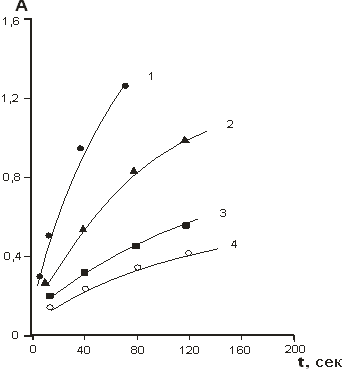
Рис. 2. Зависимость изменения оптической плотности раствора от времени экспозиции ферментативной реакции
Условия: рН 6,8; концентрация HRP 30 нг/мл;
концентрация гидрохинона: 1–0,22 мМ; 2–0,11 мМ;
3–0,05 мМ; 4–0,025 мМ
В таблице 1 приведены значения начальных скоростей реакции пероксидазного окисления гидрохинона перекисью водорода при различных концентрациях субстратов.
Таблица 1
Значения начальных скоростей реакции пероксидазного окисления гидрохинона перекисью водорода в мкМоль/сек.
Условия: [E] = 30 нг/мл; рН 5,4; t = 250С
|
Сгидрохинон,мМ
СН2О2, мМ |
0,10 |
0,20 |
0,5 |
1,0 |
|
0,17 |
2,86 |
1,76 |
4,14 |
5,14 |
|
0,42 |
2,71 |
2,36 |
8,57 |
10,0 |
|
0,85 |
2,5 |
2,28 |
8,0 |
15,6 |
|
2,5 |
2,71 |
2,0 |
7,57 |
16,9 |
|
5,0 |
1,86 |
1,14 |
9,14 |
36,0 |
Порядок ферментативной реакции был рассчитан графически из зависимости lgv0 от lg [H2O2] и lg v0 от lg [C6H4O2] (рис.3 и 4).
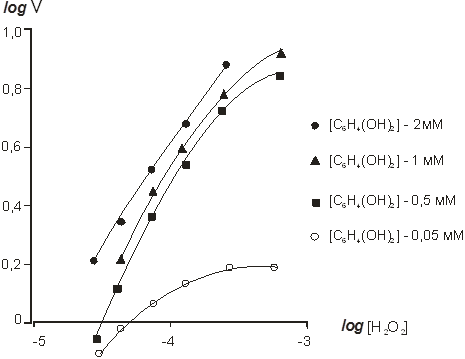
Рис. 3. Зависимость log ʋ от log [H2O2] при различных концентрациях гидрохинона
Установлено, что ферментативная реакция имеет первый порядок по перекиси водорода в диапазоне концентраций перекиси водорода 0,06–0,46 мМоль и несколько более — 1 при 1,0–3,0 мМоль. Это объясняется ингибированием ферментативной реакции высокими концентрациями перекиси водорода. Порядок ферментативной реакции по гидрохинону также близок к первому практически во всем диапазоне концентраций гидрохинона (0,2–1,5 мМоль).
Рис. 4. Зависимость log ʋ от log [С6Н4(ОН)2] при различных концентрациях перекиси водорода
Для определения основных кинетических параметров КМ, V и kкаталитич. Получена графическая зависимость начальной скорости от концентрации каждого из субстратов в координатах Лайнуивера-Берка.
На рисунке 5 приведена зависимость 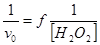 при различных концентрациях гидрохинона. Из графической зависимости следует, что в интервале концентрации перекиси водорода от 0,02 мМоль до 2,8 мМоль наблюдается линейная зависимость начальной скорости реакции от концентрации субстрата. Загиб кривой
при различных концентрациях гидрохинона. Из графической зависимости следует, что в интервале концентрации перекиси водорода от 0,02 мМоль до 2,8 мМоль наблюдается линейная зависимость начальной скорости реакции от концентрации субстрата. Загиб кривой 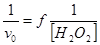 в интервале более 2,5–3,0 мМоль перекиси водорода свидетельствует об ингибировании реакции высокими концентрациями перекиси водорода.
в интервале более 2,5–3,0 мМоль перекиси водорода свидетельствует об ингибировании реакции высокими концентрациями перекиси водорода.
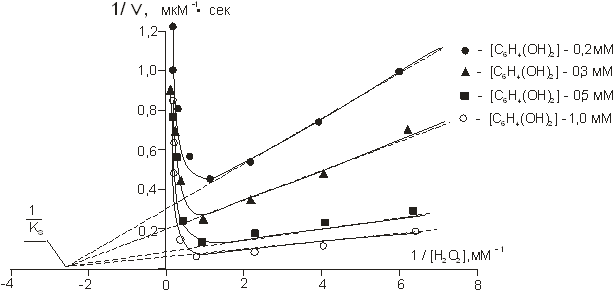
Рис. 5. Зависимость скорости ферментативной реакции от концентрации перекиси водорода в координатах Лайнуивера — Берка при различных концентрациях гидрохинона.
Увеличение начальной скорости реакции пропорционально росту концентрации гидрохинона. Точка пересечения кривых на рис.5 лежит на оси абсцисс, что говорит о неконкурентном типе ингибирования [16, 19].
Расчетное значение константы ингибирования, найденное из графика на рисунке 5, составляет 0,45 мМоль, что позволяет оценить концентрацию субстрата (перекиси водорода), достаточную для достижения максимальной скорости ферментативной реакции.
На графике Лайнуивера-Берка для гидрохинона (рис.6), соответствующего концентрации перекиси водорода 0,028–0,22 мМоль отношение 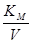 практически постоянно, что также предполагает неконкурентный механизм ингибирования большими концентрациями перекиси водорода.
практически постоянно, что также предполагает неконкурентный механизм ингибирования большими концентрациями перекиси водорода.
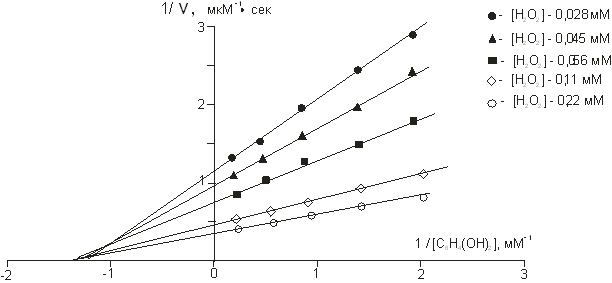
Рис. 6. Зависимость скорости ферментативной реакции от концентрации гидрохинона в координатах Лайнуивера — Берка при различных концентрациях перекиси водорода
Анализ первичных графиков (рис.6) в координатах 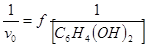 указывает на отсутствие ингибирования реакции гидрохиноном.
указывает на отсутствие ингибирования реакции гидрохиноном.
Влияние рН на кинетические параметры ферментативной реакции
С целью определения оптимума рН для реакции пероксидазного окисления гидрохинона перекисью водорода нами изучена кинетика реакции в диапазоне рН 3,6–8,2 пр постоянной концентрации гидрохинона 0,5 мМ и переменной концентрации перекиси водорода (0,028–0,224 мМ).
Полученные результаты представлены на рисунках 7 и 8. В диапазоне рН 3,6–7,4 зависимость скоростей ферментативной реакции от концентрации перекиси водорода имеет первый порядок. При повышении рН скорость ферментативной реакции возрастает и процесс каталитического окисления гидрохинона практически не зависит от рН вплоть до значений рН 8,0.
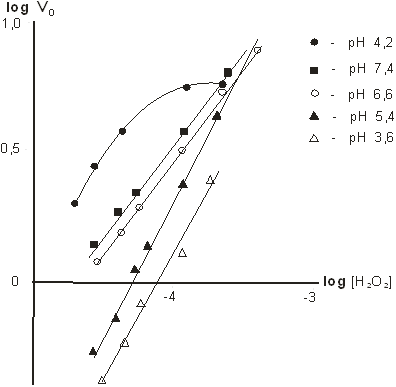
Рис. 7. Зависимость начальной скорости ферментативной реакции от концентрации перекиси водорода при различных значениях рН в логарифмических координатах
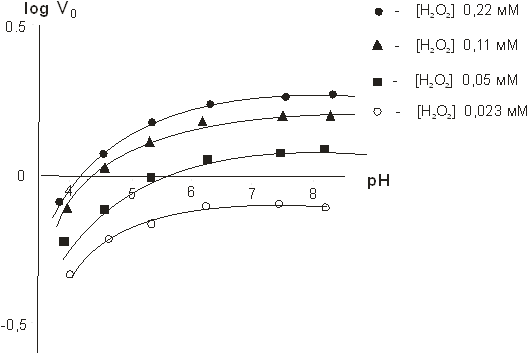
Рис. 8. Полулогарифмическая зависимость начальной скорости ферментативной реакции от рН при различных концентрациях Н2О2
Максимальная скорость ферментативной реакции наблюдается в диапазоне рН 5,8–8,5.
На рис.9 представлена зависимость кинетических параметров ферментативной реакции от рН, а в таблице 3 — количественные значения этих параметров.
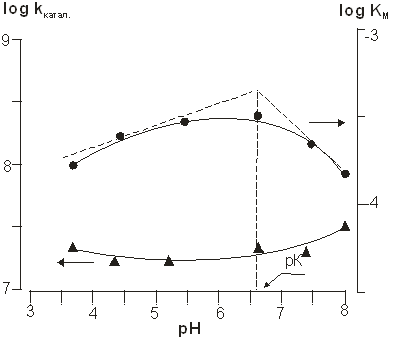
Рис. 9. Зависимость кинетических параметров ферментативной реакции от рН
Таблица 3
Значения величин кинетических параметров ферментативной реакции при разных рН
|
рН |
3,6 |
4,2 |
5,4 |
6,6 |
7,4 |
8,0 |
|
VM·106 |
16,7 |
12,5 |
13,3 |
20,0 |
15,4 |
31,2 |
|
KM· 104 |
10,0 |
1,8 |
2,0 |
2,5 |
1,4 |
0,6 |
|
kкат.·106 |
22,2 |
16,7 |
17,7 |
26,6 |
20,5 |
41,7 |
|
lg VM |
- 4,78 |
- 4,9 |
- 4,88 |
- 4,7 |
- 4,8 |
- 4,5 |
|
lg KM |
- 4,00 |
-3,74 |
-3,70 |
-3,60 |
-3,80 |
-4,20 |
|
lg kкат |
7,35 |
7,22 |
7,25 |
7,43 |
7,31 |
7,62 |
Относительное постоянство значений Ккат. В диапазоне рН 3,6–7,4 позволяет сделать вывод, что субстрат, связываясь с ферментом, не изменяет значений констант диссоциации ионогенных групп активного центра пероксидазы и, следовательно, ионогенная группа, контролирующая ферментативную реакцию, входит в состав сорбционного, а не каталитического участка активного центра.
Из рН-зависимости константы Михаэлиса КМ следует, что в белковой глобуле фермента имеется ионогенная группа с рК ~6,8, гидроксилирование которой увеличивает kкатал.. То есть, гидроксид-ионы способствуют воздействию гидрохинона на каталитический участок активного центра белковой глобулы. Возможной причиной изменения скорости ферментативной реакции при варьировании рН может быть изменение конформационной подвижности белковой глобулы и, соответственно — увеличение доступности порфиринового кольца молекуле гидрохинона. При этом необходимо учитывать и тот факт, что добавление щелочи к гидрохинону приводит к переводу последнего в активную анионную форму [19]:
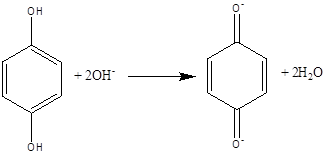
способную взаимодействовать с положителным зарядом белковой глобулы фермента, возрастающим с повышением рН.
Критерием оптимальной величины рН для пероксидазного окисления гидрохинона перекисью водорода должна служить разница между скоростями ферментативной и самопроизвольной реакций.
С этой целью нами экспериментально установлено это соотношение.
Результаты эксперимента сведены в таблицу 4.
Таблица 4
Соотношение ʋспонт./ ʋферм. при различных рН
|
рН |
ʋферм., мкМ/сек |
ʋспонт./ ʋферм. |
Концентрация гидрохинона, мМ |
Буфер |
|
3,64 |
0,8 |
0,01 |
0,1–0,5 |
Ацетатный |
|
4,18 |
1,14 |
0,02 |
0,1–0,5 |
Ацетатный |
|
5,38 |
1,67 |
0,02 |
0,1–0,5 |
Ацетатный |
|
6,58 |
2,02 |
0,025 |
0,1–0,5 |
Фосфатный |
|
7,42 |
2,18 |
0,032 |
0,1–0,5 |
Фосфатный |
|
8,0 |
5,28 |
0,05 |
0,1–0,5 |
Фосфатный |
|
8,5 |
6,12 |
0,07 |
0,1–0,5 |
Фосфатный |
Как следует из таблицы 4 наибольшая скорость ферментативного процесса при сравнительно небольшом значении ʋспонт./ ʋферм. наблюдается в слабощелочной области, т. е. рН 7,4–8,5, которая достигается введением в субстрат-ферментную смесь фосфатного буфера.
Так как повышение скорости фоновой реакции может быть обусловлено также наличием растворенного кислорода, вступающего в окислительный процесс с гидрохиноном, то целесообразно в раствор вводить антиоксиданты, например, сульфит натрия, в количестве, достаточном для связывания растворенного кислорода.
В результате проведенных исследований состав субстратной смеси для осуществления реакции пероксидазного окисления гидрохинона перекисью водорода в аналитических целях, может быть представлен следующим соотношением компонентов:
Гидрохинон — 10–3–10–2 М
Перекись водорода — 10–3–5·10–3М
Сульфит натрия — 0,05–0,1М
рН — 7,5–8,5
Выводы
Спектрофотометрическим методом изучена кинетика окисления гидрохинона перекисью водорода в присутствии пероксидазы хрена в зависимости от концентрации субстратов и рН растворов и показано:
1. Ферментативная реакция имеет первый порядок по перекиси водорода в диапазоне концентраций перекиси водорода 0,06–0,46 мМоль и несколько более — 1 при 1,0–3,0 мМоль. Это объясняется ингибированием ферментативной реакции высокими концентрациями перекиси водорода. Порядок ферментативной реакции по гидрохинону также близок к первому практически во всем диапазоне концентраций гидрохинона (0,2–1,5 мМоль).
2. В диапазоне рН 3,6–7,4 зависимость скоростей ферментативной реакции от концентрации перекиси водорода имеет первый порядок. При повышении рН скорость ферментативной реакции возрастает, и процесс каталитического окисления гидрохинона практически не зависит от рН вплоть до значений рН 8,0.
3. Концентрация перекиси водорода, достаточная для достижения максимальной скорости ферментативной реакции составляет 0,45 мМоль.
4. Концентрация гидрохинона, обеспечивающая оптимальное соотношение скоростей ферментативной и неферментативной реакций лежит в диапазоне 10–3–10–2 М, а рН — 7,5–8,5.
5. Для предотвращения самопроизвольного окисления гидрохинона с целью уменьшения фоновой реакции целесообразно в субстратную смесь добавлять 0,05–0,1 М сульфита натрия.
Литература:
1. Угарова Н. Н., Лебедева О. В., Савицкий А. П. Пероксидазный катализ и его применение. М.:МГУ, 1981. —92 с.
2. Угарова Н. Н. Применение ферментов в химическом анализе // Введение в прикладную энзимологию. Учебное пособие / Под ред. И. В. Березина, К. Мартинека. — М.: Изд-во МГУ, 1982.- С. 306–342.
3. Ивницкий Д. М. Блинов В. А., Аронбаев Д. М., Назаров А. В. Рамазанова О.А Ицекзон А. М. Биоэлектрохимические датчики в клинико-экспериментальных исследованиях // Тез.докл.XII Менделеевского съезда по общей и прикладной химии. -М.: Наука, 1981. т.1. с.270–273
4. А.с. № 1205913 СССР. Способ проведения иммуно-ферментного анализа / Ивницкий Д. М., Юлаев М. Ф., Аронбаев Д. М., Кашкин А. П., Егоров А. М., Дзантиев Б. Б., Варфоломеев С. Д. Опубл. Б.И.1986, № 3.
5. Аронбаев Д. М., Васина С. М. Кинетика и механизм пероксидазного окисления иодид-ионов перекисью водорода // Всероссийский журнал научных публикаций. — 2015. — № 1(25). — С.6–10.
6. Аронбаев Д. М., Васина С. М. Исследование влияние рН и ионной силы раствора на кинетику пероксидазного окисления иодид-ионов // Евразийский Союз Ученых. — 2014 № 9, часть 3 — С.113–118.
7. Рогожин В. В., Верхотуров В. В. Стационарная кинетика совместного окисления аскорбиновой кислоты и ферроцианида калия перекисью водорода в присутствии пероксидазы хрена// Биоорган. химия. — 1999. — Т. 25. — № 1. — С.70–73.
8. Рогожин В. В., Верхотуров В. В. Механизм совместного окисления аскорбиновой кислоты и гидрохинона в присутствии пероксидазы хрена // Биоорган, химия. — 1999. — Т. 25. — № 5. — С. 377–382.
9. Лебедева О. В., Угарова И. И. Стационарная кинетика реакции окисления NADH пероксидом водорода в присутствии пероксидазы хрена // Биохимия. — 1997. — Т. 62. — № 2. — С. 249–253.
10. Аронбаев Д. М. Криворучко В. И., Варфоломеев С. Д., Симонова М. В. Применение фотоматериалов в качестве «сухого реагента» для определения пероксидазной активности биопрепаратов // Медицинская техника. — 1990. — № 1. -С 39–40.
11. А.С. № № 1439506 СССР. Способ определения оксидоре дуктазной активности ферментов и иммуноферментных конъюгатов / Аронбаев Д. М., Криворучко В. И., Симонова М. В., Аронбаева Н. И., Варфоломеев С. Д. / Опубл. Б.И. № 43, 1988.
12. Картужанский А. Л., Красный-Адмони Л. В. Химия и физика фотографических процессов. — — Л.: Химия, 1983. — С.40.
13. Журба Ю. И., Шпольский М. Р. Фотографические процессы и материалы. — М.: Высшая школа, 1983. — С.119.
14. Кольтгоф И. М., Сендел Е. Б. Количественный анализ. 3-е изд. –М.: Госхимиздат,1948- 822 с.
15. Справочник химика. Т.4. — М-Л.: Химия, 1965. — 805 с.
16. Березин И. В., Мартинек К. Основы физической химии ферментативного катализа. Учебное пособие для студентов хим. и биол. фак. ун-тов. — М.: Высшая школа. — 280 с.
17. Диксон М., Уэбб Э. Ферменты. Т.1. — М.: Мир, 1982. — 390 с.
18. Шамб У., Сеттерфильд Ч, Вентвортс Р. Перекись водорода. –М.: Издатинлит, 1958. — 578 с.
19. Job D., Dunford H. B. Substituent effect on the oxidation of the phenols and aromatic amines by horseradish peroxidase compound I // Eur.J.Diochem. — 1976. — v.66.#3. — P.607.







