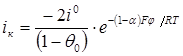Представлены результаты исследований кинетики и механизма электрохимического восстановления молекулярного йода из водных растворов на угольных электродах. Показано, что кинетические параметры электрохимической реакции (начальный потенциал восстановления, токи обмена, коэффициенты переноса) зависят от природы материала индикаторного электрода и состояния его поверхности, исходных концентраций йодид — ионов, молекулярного йода, общей ионной силы раствора. Установлено, что механизм электродной реакции восстановления йода на угольном электроде включает стадии разряда и электрохимической десорбции. Часть адсорбированного на угле йода не может принимать участие в реакциях электрохимического разряда и электрохимической десорбции. Путем катодной активации при более высоких потенциалах становится возможным регенерировать поверхность электрода за счет удаления необратимо адсорбированного йода. Определены оптимальные условия для определения йода амперометрическим методом с использованием угольных электродов.
Ключевые слова: йод-йодидная система, медиатор, йода восстановление, электрохимический процесс, кинетика и механизм, углеграфитовый электрод, поверхность, сорбция-десорбция.
Йод-йодидная система, благодаря своей простоте и электрохимической обратимости, находит свое применение в различных областях аналитической химии, таких как обычное йодометрическое титрование с визуальной или инструментальной индикацией конечной точки [1,2], так и в качестве медиаторной реакции с переносом электрона при определении биологически активных веществ с потенциометрической или амперометрической индикацией. Так, авторами [3,4] предлагается потенциометрический метод определения антиоксидантов, веществ, прерывающих свободно радикальные реакции, с использованием ред-окс пары, в качестве которой успешно может выступать йод-йодидная система. В биокаталитических методах, в том числе и иммуноферментом, предусматривающих использование пероксидазы хрена, может применяться реакция окисления иодид-ионов перекисью водорода [5,6] с последующей регистрацией результатов анализа по продукту реакции амперометрическим методом [7,8].
Такое богатое разнообразие возможного применения медиаторной йод-йодидной системы обусловливает необходимость тщательного ее изучения с целью создания на ее основе электрохимических преобразователей информации.
Для этой цели необходимо установить характер катодного восстановления йода из водных растворов; выбрать индикаторный электрод; оптимизировать условия восстановления йода на этих электродах, с учетом состояния их поверхности; установить механизм и кинетические параметры электрохимической реакции с целью прогнозирования работоспособности электрохимического сенсора.
Решению этих задач и посвящена настоящая работа.
Экспериментальная часть
Вольтамперометрические исследования по электрохимическому восстановлению йода и установлению механизма и кинетических параметров процесса проводили на компьютеризированном вольтамперометрическом комплексе [9] на базе универсального полярографа ПУ-1 (ЗИП, Гомель), работающем в режиме классической полярографии. Использовали трех-электродную ячейку с хлорсеребряным электродом сравнения и угольным вспомогательным электродом. Перемешивание раствора осуществляли механической мешалкой с постоянной скоростью. Для исключения емкостных токов и флуктуации сигнала в каждом случае подбирали условия регистрации тока.
В качестве рабочих электродов исследовались золотой, платиновый и угольный электроды. Золотой и платиновый электроды представляли собой проволоку диаметром 0,5–0,6 мм с sвидим.~ 0,1 см2
В качестве угольного электрода использовали диски из угля спектральной чистоты с sвидим ~ 0,15 см2. Согласно ТУ 01–7-67 электроды из угля для спектрального анализа марки СУ-3 выпускаются длиной 200 мм и диаметром 6±0,2 мм. Этот материал содержит только следовые количества (< 10–5 %) железа, алюминия, бора, меди, марганца, магния и кальция.
Перед измерениями металлические электроды обрабатывали горячими концентрированными азотной и соляной кислотами и промывали дистиллированной водой. Угольные электроды парафинировали под вакуумом в течение 2–3 часов и полировали на поверхности фильтровальной бумаги до зеркального блеска.
Потенциометрические измерения включали определение рН буферных и анализируемых растворов. Для определения рН служил иономер И-130 со стеклянным электродом ЭСЛ-43–07 и автоматической компенсацией изменения температуры. Погрешность измерения не превышала ± 0,02 рН в диапазоне измерений рН 3,0–8,5.
Результаты и их обсуждение
1. Выбор материала индикаторного электрода
Несмотря на то, что в литературе имеются многочисленные сведения об изучении йод-йодидной электрохимической системы, в настоящее время еще отсутствует целостная картина процессов катодного восстановления йода, что объясняется влиянием материала, как самого электрода, так и состояние его поверхности на свойства окислительно-восстановительной системы [10–12].
Как нами уже отмечалось выше, мы использовали платиновый, золотой и угольный электроды.
Выбор углеграфитовых материалов в качестве основы для изготовления индикаторных электродов обусловлен тем, что практически все материалы, включая и благородные золото и платину, образует пассивные пленки на своей поверхности, нарушающие нормальное течение электрохимического процесса, в то время как с углеграфитовыми электродами эти явления не так заметны [13].
В таблице 1 приведены основные характеристики используемых в практике углеграфитовых материалов [14].
Таблица 1
Характеристики электродов из углеграфитовых материалов [14].
|
Характеристика |
Уголь для спектрального анализа |
Стеклоуглерод |
Графит МГ МПГ-6, МПГ-8 |
Особо чистый пирографит |
|
Плотность, г/см3 |
1,65 |
_ |
1,76–1,88 |
2,1–2,15 |
|
Зольность, % |
10–3 |
- |
0,005–0,01 |
- |
|
Пористость, % или радиус пор, мкм |
25 % |
различная |
1,4–2,4 мкм |
0,1 % |
|
Предел прочности, мгс/см2 |
250 |
650–700 |
500 |
_ |
|
Удельное электрическое сопротивление, ом·мм2/м |
20 |
45–50 |
11–16 |
4500 перпендикулярно плоскости осаждения, 345 параллельно плоскости осаждения |
|
Газопроницаемость по гелию, см2/сек |
значит. |
|
0,5–0,8 |
10–8 |
Как видно из таблицы характерной особенностью чистого пирографита является ярко выраженная анизотропия основных физико-механических свойств, высокая плотность, малая пористость, низкая газопроницаемость, что делает его превосходным материалом для изготовления электродов. Однако, недостаточная прочность и большой градиент удельного сопротивления по плоскости осаждения пирографита, высокий остаточный ток затрудняет использование этого материала для изготовления индикаторных электродов амперометрических датчиков [15].
В последнее время применяются новые сорта углеродистых материалов, имеющих крайне низкую проницаемость для газов и высокую устойчивость при окислении. К таким материалам относится сетчатый стеклоуглерод [16]. Однако характеристики различных сетчатых стеклоуглеродных материалов весьма различаются и трудно унифицировать изготовленные из них индикаторные электроды [17].
Доступность, легкость в обработке, хорошие физико-химические и механические характеристики делают угольные электроды для спектрального анализа приемлемым конструкционным материалом при разработке амперометрических датчиков. Поэтому при условии стабилизации поверхности электроды для спектрального анализа могут быть использованы в качестве индикаторных. Физико-химическая обработка электродных заготовок обычно включает в себя методы стабилизации диаметра пор и удельной поверхности. Стабилизацию поверхности угольных электродов мы проводили парафинированием с последующим полированием на фильтровальной бумаге.
Поляризационные кривые снимали на переменно-токовом полярографе ПУ — 1, работающем в режиме классической полярографии при скорости развертки потенциала 2 мв/сек.
На рис. 1 приведены поляризационные кривые восстановления йода в различных фоновых электролитах, полученных на платиновом электроде с использованием 3-х электродной ячейки с угольным вспомогательным электродом.
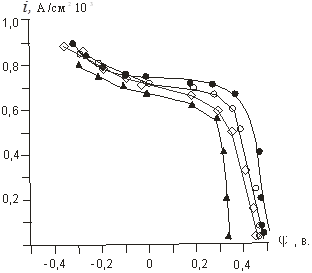
Рис. 1. Катодные кривые восстановления йода (10–3 М) на платиновом электроде в 0,1 М растворах ацетата натрия (I), сульфата калия (2), хлористого калия (3),иодида калия (4)
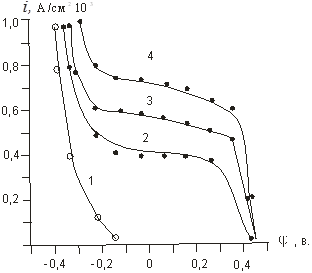
Рис. 2. Поляризационные кривые восстановления различных концентраций йода на угольном электроде на фоне 0,1 М раствора хлористого калия (I); 0,5 мМ (2); 0,7мМ (3), 1,0 мМ (4).
Как видно, рабочая область потенциалов восстановления йода не зависит от состава раствора электролита, за исключением раствора КJ. С увеличением концентрации йодида калия начальный потенциал восстановления йода смещается в отрицательную, катодную область, тем самым наблюдается уменьшение площадки предельного тока. Результаты этих исследований представлены в таблице 2.
Таблица 2
Зависимость величины рабочей области потенциалов восстановления йода от концентрации йодида калия.
|
Концентрация KJ, M |
Начальный потенциал восстановления J2 мв |
Граница площадки предельного тока, мв |
Δφ, мв |
|
0,1 |
317 |
34 — -217 |
251 |
|
0,01 |
400 |
200 — -185 |
385 |
|
0,001 |
484 |
232 — -234 |
466 |
Условия: [J2] = 10–4 М, электрод Pt с sвидим.=0,1 см2 фоновый электролит — 0,1 М KCI, рН 4, электрод сравнения — насыщенный хлорсеребряный, t = 24°С
В таблице 3 приведены зависимости величины рабочей области потенциалов восстановления йода от природы измерительного электрода и эффективность электрохимического процесса.
Таблица 3
Зависимость величины рабочей области потенциалов восстановления J2 от материала индикаторного электрода.
|
Измерительный электрод |
Начальный потенциал восстановления, мв |
Граница площадки предельного тока, мв |
Эффективность по току, % |
|
Аu |
500 |
268 — -251 |
96,5 |
|
Pt |
484 |
232 — -234 |
100,0 |
|
С |
466 |
285 — -117 |
100,0 |
Условия: [J2] = 0,001 М; фон 0,1 М КСl, рН 3,6.
При использовании золотого электрода, как рабочая область потенциалов, так и плотность тока восстановления превосходит эти же характеристики для платинового и угольного электрода. Однако, угольный и платиновый электроды обеспечивают 100 % выход по току, т. е., наивысшую эффективность процесса восстановления йода.
В связи с этим в дальнейшем в качестве индикаторного электрода мы использовали только угольные электроды из спектрального угля с различной техникой стабилизации рабочей поверхности.
2. Кинетика и механизм восстановления йода на угольных электродах
О кинетике электрохимической реакции можно судить по величине тока обмена, которая зависит от природы электрохимической реакции, материала электрода, состава раствора [18]. Коэффициент переноса α в этом случае характеризует степень влияния электрического поля электрода на энергию активации электрохимической стадии и определяет симметрию катодного и анодного процессов. Величины i0 и α для одностадийного электрохимического акта находили графически [19]. Для этого поляризационную кривую строили в координатах φ — lgi.
Так как катодную поляризацию можно описать уравнением
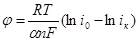 , а для анодного процесса:
, а для анодного процесса: 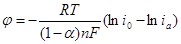
то наклон прямой φ — lgi равен 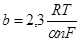 и значит
и значит 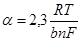
Ток обмена находили по величине перенапряжения Δφ = α, при lgi =0 при единичной плотности тока: 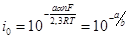
На рисунке 2 приведены поляризационные i,φ — зависимости восстановления йода на угольном электроде. Ход кривых этих зависимостей аналогичен ходу кривых поляризации, на платиновом электроде.
Величина предельного тока восстановления находится в прямо пропорциональной зависимости от концентрации йода в растворе. С целью выяснения влияния рН на кинетику катодного восстановления йода нами была определена площадка предельного тока на угольном электроде при различных рН рабочих растворов. Результаты этих исследований представлены в таблице 4.
Таблица 4
Величина площади предельного тока восстановления йода при различных рН фонового электролита
|
рН |
Буфер |
Границы площадки предельного тока, мв |
Δ φ, мв |
|
1,68 |
Глицин-HCI |
330 — -125 |
455 |
|
3,01 |
Глицин-HCI |
312 — -114 |
426 |
|
4,12 |
Ацетатный |
301 — -112 |
423 |
|
5,45 |
Ацетатный |
261 — -104 |
365 |
|
6,86 |
Фталатный |
201 — -90 |
291 |
|
8,92 |
Фосфатный |
114 — -84 |
198 |
Условия: электрод — угольный c s видим. ~ 0,15 см3, температура 19°С, скорость развертки потенциала 5 мв/сек, концентрация J2 10–4 М.
Из таблицы 4 следует, что уменьшение рН смещает начальный потенциал восстановления в анодную область потенциалов и в то же время расширяет границы площадки предельного тока. Однако, следует отметить, что при значениях рН < 3 возможна реакция окисления йодид — ионов кислородом воздуха по схеме: 4 J- + 02 + 4 H+ → 2 J2 + 2 H2O
В связи с этим наиболее целесообразно поддерживать величину рН в диапазоне 3,5–4,5. При этих значениях рН площадка предельного тока имеет достаточно широкую границу. Такую величину рН можно поддерживать натрий-ацетатным буфером с добавкой KCI для увеличения электропроводности.
На рисунке 3 приведены катодные поляризационные кривые восстановления трийодид-иона на угольном электроде на фоне различных количеств йодистого калия.
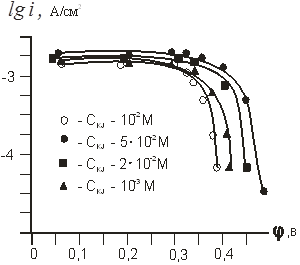
Рис. 3. Катодные кривые восстановления J2 (10–3 М) на угольном электроде на фоне KJ различной концентрации.
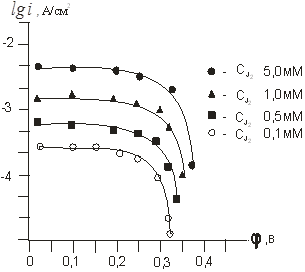
Рис. 4. Катодные кривые восстановления йода на угольном электроде при постоянной концентрации йодида калия (0,1 М) и переменной концентрации J2.
Увеличение количеств йодид-ионов при данном потенциале электрода приводит к возрастанию скорости анодной реакции и уменьшению скорости катодного восстановления йода. Параллельность прямолинейных участков lgi,φ — кривых для растворов с переменной концентрацией J3- и постоянной концентрации J- — ионов позволяет путем экстраполяции к φ = 0 рассчитать катодные токи обмена для каждого конкретного случая (рис.4).
При φ = 0 (отн. Ag/AgCl) график зависимости lgi от lg [J-] представляет собой прямую линию с наклоном 1,3 и на фоне 0,1 М натрий-ацетатного буфера (рН 4,0). 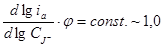 , что указывает на первый порядок анодной реакции по J-.
, что указывает на первый порядок анодной реакции по J-.
Порядок катодной реакции по J- и J2 нами определен приближенно, так как наклон прямолинейных участков lgik..,φ — кривых меняется с изменением концентрации J- и J2 (см. рис.4). При использовании кривых с близкими значениями наклона порядок катодной реакции по йодид — иону для растворов на указанном фоновом электролите около — 1.
Порядок электрохимической реакции по J2, который из lgik..,φ-кривых можно определить весьма приближенно, получаются равными 0,8–1,1.
Как видно из рисунка 3, токи в диапазоне поляризации 0–0,32 в, не зависят от концентрации иодид-ионов. Если учесть изменение равновесной концентрации йодид-ионов при изменении концентрации J2 вследствие комплексообразования по схеме: J- + J2 →J3, то порядок анодной реакции по J2 = 0.
Резюмируя вышеизложенное, отметим, что порядок электродных реакций по компонентам электрохимической системы будет следующий:
 ;
;
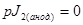 ;
;
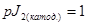 ;
;
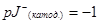
В таблице 5 представлены кинетические параметры реакции в системе йод-йодид на угольном электроде.
Экспериментальный ток обмена i° эксп определяли по наклону прямой i∞,φ при малых перенапряжениях (Δφ ~ 10–20 мв). Воспроизводимость опытных данных составила 10–15 % по iэксп и 20–25 % по αк. Большой разброс кинетических параметров для катодной реакции объясняется, тем, что lgi., φ-кривая имеет прямолинейный участок лишь в узкой области потеницалов, которая сужается с ростом отношения концентрации [J2] / [J-].
Таблица 5
Кинетические параметры электрохимической реакции в системе йод-йодид-электрод
|
|
|
|
|
|
|
|
|
|
||
|
Pt* |
C |
Pt* |
C |
|||||||
|
10–3 |
10–2 |
- |
4,8 |
6,1 |
1,7 |
3,0 |
0,5 |
1,3 |
1,8 |
3,6 |
|
2·10–3 |
10–2 |
- |
4,9 |
6,0 |
2,1 |
3,3 |
0,4 |
1,2 |
1,6 |
3,8 |
|
5·10–3 |
10–2 |
- |
5,1 |
7,0 |
1,9 |
3,2 |
0,4 |
0,7 |
1,1 |
4,0 |
|
10·10–3 |
10–2 |
- |
5,5 |
7,1 |
2,9 |
4,1 |
0,4 |
0,7 |
1,1 |
4,2 |
|
10–3 |
10–2 |
0,1 |
11,6 |
14,1 |
5,4 |
6,1 |
0,4 |
1,1 |
1,5 |
9,0 |
|
10–3 |
10–2 |
0,2 |
19,2 |
22,0 |
6,8 |
7,3 |
0,35 |
1,3 |
1,65 |
11,3 |
|
10–3 |
10–2 |
0,5 |
31,0 |
40,6 |
11,1 |
11,1 |
0,5 |
1,6 |
2,1 |
14,1 |
|
10–3 |
10–2 |
1,0 |
38,5 |
45,1 |
13,5 |
14,5 |
0,5 |
1,5 |
2,0 |
21,0 |
Для растворов с большой концентрацией электролита, более 0,5 М KCI, разброс кинетических параметров несколько выше, чем для растворов с малым содержанием индифферентного электролита или вообще без него. Сумма коэффициентов переноса, вычисленная из αанод. и αкатод. изменяется в широких пределах в зависимости от концентрации компонентов электрохимической реакции. При возрастании концентрации KJ и KCI сумма αанод. + αкатод приближается к 2, ас возрастанием концентрации J2 эта сумма уменьшается.
Токи обмена как катодной, так и анодной реакций, полученные с угольным электродом, несмотря на один порядок измерения с Pt-электродом, заметно выше. Этот факт и то, что сумма коэффициентов переноса больше 1, указывает на то, что суммарная электрохимическая реакция в системе J2/J- на угле протекает по следующим стадиям:
|
J3- ↔ J2 + J- |
(а) |
|
J2 + e-↔ J- + Jадсорб. |
(б) |
|
J2 ↔ 2Jадсорб. |
(в) |
|
Jадсорб. + e- ↔ J- |
(г) |
|
J3- + 2e-↔3J- |
(д) |
Наличие комплексного иона и его диссоциация (а) может оказывать влияние на скорость электродного процесса при наличии диффузионных ограничений [12,20]. Однако, порядок катодной реакции по J- = -1, указывает на то, что реагирующей частицей на катоде является J2 а не J3-. Поэтому уменьшение скорости катодной реакции при возрастании концентрации J- объясняется объемным комплексообразованием по реакции (а). Суммарная электродная реакция (д) может происходить либо путем сочетания процессов (в) и (г) — рекомбинация — разряд, либо по (б) и (г) — разряд — электрохимическая десорбция. В то же время, если бы лимитирующей стадией во всей области потенциалов была бы какая-либо одна из этих реакций, то токи обмена, полученные путем экстраполяции анодных и катодных lgi, φ- кривых к φ → 0, совпадали бы между собой.
А поскольку в действительности этого не наблюдается (см. таблицу 16), то следует предположить, что последовательные процессы реакции (в) и (г); (б) и (г) протекают с соизмеримыми скоростями. При допущении, что процесс восстановления йода — окисления йодида происходит по реакциям (в) и (г) и токи обмена реакции (г) больше, чем (в), то катодная реакция будет лимитироваться скоростью адсорбции йода на угле, а анодная — скоростью десорбции и рекомбинации атомарного йода. В этом случае зависимость величины катодного тока от φобусловлена изменением степени покрытия электрода с потенциалом по реакции (г). Для последовательно осуществляемых реакций (в) и (г) при малых степенях покрытия зависимость lgiк, φ существенно нелинейна и при сравнимых токах обмена обеих стадий iк должен быстро достигать предельного тока диссоциации молекулярного йода. Степень покрытия электрода очевидно, будет уменьшаться с ростом φ катод.в виду электровосстановления Jадсорб. Из рисунков катодного восстановления J3- видно, что изменение потенциала в сторону увеличения катодных значений приводит к увеличению катодных токов и на кривых lgiк, φ — появляются линейные участки. И этот факт противоречит принятой нами схемы по реакциям (в) и (г).
В связи с этим остается более приемлемым механизм электровосстановления суммарной реакции (д): механизм по реакциям (б) и (г), т. е.
|
J2 + e- ↔ J- + Jадсорб. |
(разряд) |
|
Jадсорб. + e- ↔ J- |
(электрохимическая десорбция) |
|
J2 + 2e- ↔ 2J- |
|
Этот механизм согласуется с экспериментальными данными. При концентрации йодид-ионов существенно превышающей концентрацию йода анодный ток обмена больше тока обмена катодного процесса и их сумма αа+αк ~ 2, степень покрытия угольного электрода больше нуля и, очевидно, лимитирующей стадией является реакция электрохимической десорбции.
При соизмеримых концентрациях йодид-ионов и йода сумма αа+αк ~ 1 и экспериментальные зависимости тока от потенциала описывается соответствующими уравнениями:
|
|
|
где θ0 — степень покрытия поверхности угольного электрода.
Очевидно, адсорбированный йод не может принять участие в реакциях (б, в, г) в виду обмена с йодом в растворе. Можно предположить, что кроме связанного с поверхностью угольного электрода йода существует еще и обратимо адсорбированный йод, который является электроактивным, т. е. восстанавливающийся при катодной поляризации.
При длительной выдержке электрода в растворе, содержащем комплексный ион J3- величина токов обмена катодного процесса уменьшается во времени. Этот факт объясняется тем, что на поверхности электрода во времени количество необратимо адсорбированного йода увеличивается и наблюдается эффект пассивации электрода.
На рисунке 5 приведены поляризационные кривые катодного восстановления йода в растворе 0,01 М KJ с добавкой 0,3 М KCl.
Первая кривая была получена сразу после активации угольного электрода, 2 и 3 кривые — через 1 час и 3 часа, соответственно, после погружения электрода в анализируемый раствор, 4 кривая получена после катодной поляризации электрода с разверткой потенциала 50 мв/сек.
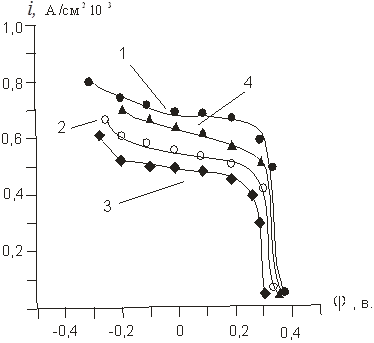
Рис. 5. Поляризационные кривые катодного восстановления йода (10–3 М) в растворе 0,01 М KJ с добавкой 0,3 М KCI, полученные сразу после активации угольного электрода (1), через 1 час (2), через 3 часа (3) после погружения
Как видно, катодная поляризация при повышенных потенциалах в значительной степени стабилизирует электродные характеристики. Это можно объяснить ускоренной электрохимической десорбцией пленки йода и увеличением свободной поверхности электрода.
Выводы
Исследование кинетики и механизма электрохимического восстановления йода на индифферентных электродах показало, что:
1. Кинетические параметры электрохимической реакции (начальный потенциал восстановления, токи обмена, коэффициенты переноса) зависят от природы материала индикаторного электрода и состояния его поверхности, исходных концентраций йодид — ионов, молекулярного йода, общей ионной силы раствора.
2. Механизм электродной реакции восстановления йода на угольном электроде включает стадии разряда и электрохимической десорбции. Часть адсорбированного на угле йода не может принимать участие в реакциях электрохимического разряда и электрохимической десорбции.
3. Путем катодной активации при более высоких потенциалах становится возможным регенерировать поверхность электрода за счет удаления необратимо адсорбированного йода.
4. Оптимальными условиями для амперометрического определения йода являются следующие: концентрация йодид — ионов <10–2 г-ион/л; рН 3,5–4,5; ионная сила раствора 0,3–0,5 М; индикаторный электрод — уголь спектральной чистоты, 0,00 вольт отн. Ag/AgCl.
Литература:
1. Кольтгоф И. М., Сендел Е. Б. Количественный анализ. 3-е изд. — М.: Госхимиздат, 1948- 822 с.
2. Сонгина О. А.,Захаров B. A. Амперометрическое титрование. — М.: Химия. -1979.- С.19
3. Патент РФ № 2486499. Способ определения оксидантной / антиоксидантной активности веществ и устройство для его осуществления / Брайнина Х. З., Герасимова Е. Л., Ходос М. Я., Викулова Е. В., Чернов В. И., Носкова Г. Н. Заяв.№ 2012113918 от 10.04. 2012. Опубл. 27.07.2013.
4. Брайнина Х. З., Иванова А. В., Шарафутдинова Е. Н. Оценка антиоксидантной активности пищевых продуктов методом потенциометрии. // Известия высших учебных заведений. Пищевая технология. — 2004. — № 4. С. 73–75.
5. Bjorksten F. Peroxidase-catalyzed iodide oxidation I. // Biochim. Biophys. Acta — 1970. — V. 212. — P. 396–406.
6. Аронбаев Д. М., Васина С. М. Кинетика и механизм пероксидазного окисления иодид-ионов перекисью водорода // Всероссийский журнал научных публикаций. — 2015. — № 1(25). — С.6–10.
7. А.с. № 1205913 СССР. Способ проведения иммуно-ферментного анализа / Ивницкий Д. М., Юлаев М. Ф., Аронбаев Д. М., Кашкин А. П., Егоров А. М., Дзантиев Б. Б., Варфоломеев С. Д. // Б.И.1986, № 3.
8. Аронбаев Д. М. Разработка принципов амперометрической детекции в твердофазном иммуноферментном анализе.// Автореф... канд.хим наук. — М.: МГУ, 1987. — 21 с.
9. Аронбаев С. Д., Насимов А. М., Аронбаев Д. М., Насыров Р. Х. Компьютеризированный аналитический комплекс для инверсионной вольтамперометрии на базе универсального полярографа ПУ-1 // Илмий тадкикотлар ахборотномаси СамДУ (Научный вестник СамГУ). — 2009. — № 1(53). — С. 47–50.
10. Трухан A. M.,Поваров Ю. М.,Луковцев П. Д. Кинетические параметры электродных реакций в системе иод-иодид на иридиевом электроде //Электрохимия — 1970.-T.6.- № 5.- C.744–745.
11. Newson D., Raddiford A. Electroreduction in system Pt-J- /J2 // J. Electrochem. Soc. — 1961. — V. 108. — P. 695–699.
12. Поваров Ю. М., Барбашева И. Е. Константы нестойкости трииодид иона в диметилформамиде. // Электрохимия — 19б7.-Т.5.- № 6. — С. 745–747.
13. Поваров Ю. М., Ерошкина Л. В., Луковцев П. Д. Влияние адсорбирующих катионов на катодный и анодный процессы в системе иод-иодид.// Электрохимия — 1970.-Т.6,№ 10.- С.1450–1455.
14. Рогайлин М. И.,Чалых Е. Ф. Справочник по углеграфитовым материалам. — Л.: Химия.-1974. — 208 с.
15. Фиалков А. С., Бавер А. И., Сидоров Н. М., Чайкун М. И., Рабинович С. М. Пирографит. Получение, структура, свойства // Успехи химии. — 1965. –Т.34. № 1. — С. 46–58.
16. Wang J. Reticuleted vitreous carbon — a new versatile electrode material// Electrochim. Acta — 1981. — V. 26, No. 12. — P. 1721–1726.
17. Ranganathan S., McCreery R., Majji S. M., Marc Madoua M. Photoresist-Derived Carbon for Microelectromechanical Systems and Electrochemical Applications //J. Electrochem. Soc. — 2000. — V. 147. — № 1. — Р. 277–282.
18. Феттер К. Электрохимическая кинетика. М.-Л.: Химия,-1967.-674 с.
19. Антропов Л. И. Теоретическая электрохимия. — М.: Высшая школа, 1969. — 325 с.
20. Барабашева И. Е., Поваров Ю. М., Луковцев П. Д. Кинетика электродных реакций в системе йод — йодид. // Электрохимия — 1970.- т.6. -№ 11.-С. 92–97.







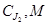
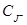 , г-ион/л
, г-ион/л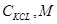
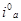
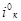
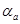
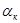
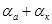
 , мА/см2
, мА/см2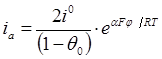 и
и