Ключевые слова: хроническая обструктивная болезнь легких, цитокины, курение, качество жизни, обострения.
Keywords: chronic obstructive pulmonary disease, cytokines, smoking, quality of life, exacerbations.
Актуальность. Хроническая обструктивная болезнь легких (ХОБЛ) характеризуется персистирующим ограничением скорости воздушного потока, обычно прогрессирующим и связанным с повышенным хроническим воспалительным ответом легких на действие патогенных частиц или газов. Среди лиц старше 40 лет распространенность заболевания приближается к 10 %. Ежегодно ХОБЛ становится причиной смерти около 3 млн. человек, при этом, смертность от данной патологии стремительно растет. По прогнозам ВОЗ, к 2020 году ХОБЛ войдет в первую тройку причин заболеваемости и смертности в мире [1].
Существенной проблемой в отношении ХОБЛ является ее лечение. В настоящее время терапия ХОБЛ носит преимущественно симптоматический характер и не позволяет замедлить прогрессирование заболевания. Поэтому продолжается изучение механизмов развития данной патологии [1].
На протяжении последних десятилетий внимание ученых было сосредоточено на попытках выяснения молекулярных и клеточных механизмов развития ХОБЛ. Было установлено, что в формирование хронического воспаления легочной ткани при этом заболевании вовлечены клетки крови, среди которых наибольшее значение имели макрофаги, нейтрофилы и лимфоциты. Эти клетки принимают участие в формировании деструктивных изменений легочной ткани. В реализации их функциональной активности принимают участие цитокины. Эти белковые молекулы преимущественно синтезируются клетками иммунной системы и участвуют в формировании воспалительных реакций, в том числе, привлечении иммунокомпетентных клеток из кровотока в очаг воспаления в легких.
Среди провоспалительных цитокинов существенное значение в развитии и усилении воспалительной реакции при ХОБЛ оказывают интерферон γ (IFN-γ) и хемокин CXCL11. Однако данные об изменении их концентрации в крови при ХОБЛ достаточно противоречивы [2]. Нередко в этих исследованиях пациенты анализировались без учета фактора курения. Между тем, имеются сведения молекулярно-клеточных особенностях развития этого заболевания у курящих и некурящих пациентов [3].
Целью исследования явилось определение закономерностей количественного изменения IFN-γ и CXCL11 в плазме крови курящих и некурящих пациентов с ХОБЛ, а также оценка их взаимосвязи с качеством жизни пациентов и частотой предшествующих обострений.
В ходе работы нами былиобследованы 21 некурящий пациент с ХОБЛ, 20 курящих пациентов с ХОБЛ, 20 некурящих здоровых людей и 21 здоровый курильщик. К некурящим были отнесены люди, выкурившие менее 100 сигарет в течение жизни [4]. ХОБЛ у обследованных некурящих пациентов была обусловлена вдыханием производственных вредностей, а также перенесенными тяжелыми инфекционными заболеваниями дыхательных путей в раннем детстве и/или частыми острыми респираторными заболеваниями в зрелом возрасте. Все пациенты были обследованы в период стабильного течения ХОБЛ. Критериями исключения являлись бронхиальная астма, атопия, аллергический ринит, туберкулез, острые инфекционные заболевания, нарушения свертывающей системы крови, прием системных глюкокортикостероидов в течение 2 месяцев до проведения исследования, неспособность правильно выполнить дыхательный маневр при тестировании функции внешнего дыхания. Диагностика ХОБЛ, включая оценку ее степени тяжести, осуществлялась на основании общепринятых критериев [1].
Оценка функции внешнего дыхания осуществлялась по стандартной методике на аппарате SpiroUSB с использованием программного обеспечения Spida5 (Micro Medical Limited, Великобритания) в соответствии с рекомендациями Американского торакального и Европейского респираторного сообществ.
Оценка качества жизни пациентов с ХОБЛ осуществлялась с использованием шкалы CAT (COPD Assessment Test, оценочный тест по ХОБЛ). В соответствии с результатами CAT-теста обследованные пациенты были разделены на 2 группы. В первую группу вошли пациенты с количеством баллов по тесту ≤20, что соответствовало незначительному и умеренному снижению качества жизни (КЖ) (n=21). Вторую группу составили пациенты с суммарным баллом >20, что отражало выраженное и резко выраженное снижение КЖ (n=16).
Количество обострений ХОБЛ в анамнезе определялось согласно классификации N. R. Anthonisen [5].
Венозную кровь у обследуемых пациентов забирали рано утром натощак в объеме 10 мл в пробирку, содержащую в качестве антикоагулянта этилендиаминтетраацет калия. Для получения плазмы образцы центрифугировали по истечении одного часа после забора крови с параметрами центрифуги: 3000 об/мин, 15 мин. Образцы хранили при температуре -75oC вплоть до проведения анализа. В плазме крови определяли концентрацию IFN-γ и CXCL11 («Вектор-Бест», РФ; «R&D Systems», США) методом иммуноферментного анализа на иммуноферментом анализаторе «StatFax 3200» («Awareness Technology», США). Статистическую обработку проводили с помощью пакета прикладных программ Statistica for Windows 10.0 методами непараметрической статистики. О взаимосвязи между показателями судили на основании расчета коэффициента ранговой корреляции Спирмена (R). При всех видах статистического анализа критическое значение уровня значимости принимали равным 5 %.
Результаты и обсуждение. Установлено, что уровень CXCL11 в плазме крови был значительно выше у некурящих пациентов с ХОБЛ, чем у здоровых некурящих людей. У курящих пациентов подобные изменения этого цитокина отсутствовали (таблица 1).
Концентрация IFN-γ, как и в случае CXCL11, повышалась у некурящих пациентов с ХОБЛ по сравнению с некурящими здоровыми людьми, но существенно не различалась у курящих пациентов с ХОБЛ и здоровых курильщиков.
Таблица 1
Концентрация цитокинов в плазме крови курящих и некурящих пациентов с ХОБЛ
|
Некурящие |
Курящие |
|||
|
Цитокин |
ХОБЛ |
Контроль |
ХОБЛ |
Контроль |
|
IFN-γ, пг/мл |
2,0 (1,2–3,0)* |
1,2 (0,15–1,8) |
1,2 (0,15–2,2) |
1,2 (0,3–2,2) |
|
CXCL11, пг/мл |
83,0 (55,0 -119,0)* |
56,5 (44,0–71,0) |
54,5 (45,5–84,0) |
63,0 (49,0–128,0) |
Примечание: данные представлены как медиана (25 %-75 %); * — p < 0,05 по сравнению со здоровыми некурящими людьми.
У мужчин и женщин, страдающих ХОБЛ, концентрация цитокинов была одинаковой, независимо от того, курили они или нет.
IFN-γ оказывает существенное влияние на секрецию CXCL11 [6]. Взаимодействие IFN-γ с соответствующим рецептором на поверхности моноцитов и эпителиальных клеток бронхов усиливало синтез этими клетками CXCL11. В нашем исследовании также обнаружена умеренная положительная корреляционная связь между концентрацией этих цитокинов в плазме крови пациентов с ХОБЛ (R = 0,521, p < 0,001) (рисунок 1). Полагают, что связывание CXCL11 с CXCR3 рецептором лимфоцитов предрасполагает к миграции этих клеток из кровотока в легкие [7]. В свою очередь, Т-лимфоциты, обладающие рецепторами CXCR3, достигнув воздухоносных путей, начинают секретировать IFN-γ, и таким образом, еще больше стимулируют привлечение лимфоцитов в легкие [8].
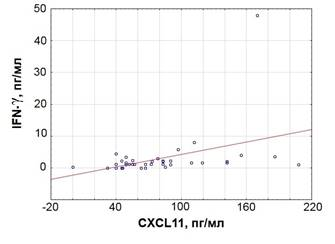
Рис. 1. Корреляционная связь между концентрацией IFN-γ и CXCL11 в плазме крови пациентов с ХОБЛ
Полученные результаты демонстрируют значительно более высокую концентрацию IFN-γ и CXCL11 в крови общей группы пациентов с ХОБЛ (без учета фактора курения) с выраженным и резко выраженным снижением КЖ, чем у пациентов с незначительным и умеренным снижением КЖ (таблица 2).
Таблица 2
Концентрация цитокинов в плазме крови пациентов с ХОБЛ в зависимости от результатов СAT
|
Цитокин |
CAT ≤20 |
CAT>20 |
Уровень значимости, p |
|
IFN-γ, пг/мл |
1,0 (0,0–1,6) |
2,0 (1,4–3,3) |
0,010 |
|
CXCL11, пг/мл |
49,0 (45,0–83,0) |
96,0 (70,0–142,0) |
0,001 |
По результатам проведённого корреляционного анализа обнаружена прямая корреляционная связь между результатом CAT и концентрацией IFN-γ и CXCL11 в периферической крови пациентов с ХОБЛ (независимо от статуса курения) (R = 0,410, p = 0,01 для IFN-γ, R = 0,454, p = 0,005 для CXCL11) (рисунок 2).
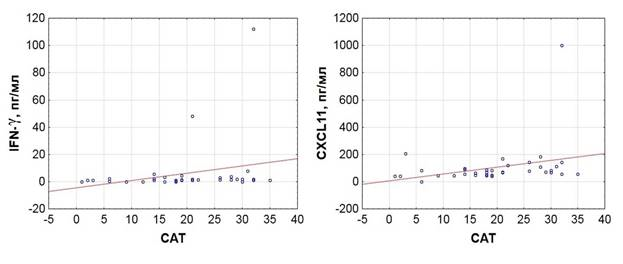
Рис. 2. Связь плазменного уровня IFN-γ и CXCL11 с результатом CAT-теста у пациентов с ХОБЛ
Аналогичные результаты были получены при определении корреляционной связи между частотой обострений у пациентов с ХОБЛ за предшествующие забору крови 12 месяцев и концентрацией этих цитокинов (R = 0,537, p < 0,001 для IFN-γ; R = 0,417, p = 0,01 для CXCL11) (рисунок 3).
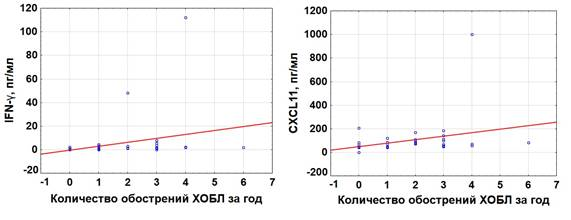
Рис. 3. Связь между частотой обострений и концентрацией IFN-γ и CXCL11 в плазме крови пациентов с ХОБЛ
Выводы. Только у некурящих пациентов имеет место более высокий уровень IFN-γ и CXCL11. У пациентов, страдающих ХОБЛ, имеется положительная корреляционная связь между уровнем IFN-γ и CXCL11 и количеством предшествующих обострений. У пациентов с выраженным и резко выраженным снижением качества жизни концентрация IFN-γ и CXCL11 существенно выше, чем у пациентов с ХОБЛ с незначительным и умеренным снижением качества жизни.
Литература:
1. Global Strategy for the Diagnosis, Management, and pvention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2011.
2. Tanni S. E., Pelegrino N. R., Angeleli A. Y. et al. Smoking status and tumor necrosis factor-alpha mediated systemic inflammation in COPD patients. J. Inflamm. 2010; 7: 29.
3. Garcia-Rio F., Miravitlles M., Soriano J. B. et al. Systemic inflammation in chronic obstructive pulmonary disease: a population-based study. Respir. Res. 2010; 11: 63.
4. World Health Organization. Guidelines for controlling and monitoring the tobacco epidemic (2008): WHO, Genewa.
5. Anthonisen N. R., Manfreda J., Warren C. P. et al. Antibiotic therapy in exacerbations of chronic obsructive pulmonary disease. Ann. Intern. Med. 1987; 106 (2): 196–204.
6. Interferon-inducible T cell alpha chemoattractant (I-TAC): a novel non-ELR CXC chemokine with potent activity on activated T cells through selective high affinity binding to CXCR3 / K. E. Cole [et al.] // J. Exp. Med. — 1998. — Vol. 187, № 12. — P. 2009–2021.
7. Torvinen, M. The role of IFN-γ in regulation of IFN-γ-inducible protein 10 (IP-10) expssion in lung epithelial cell and peripheral blood mononuclear cell co-cultures / M. Torvinen, H. Campwala, I. Kilty // Respir. Res. — 2007. — Vol. 8:80. — P. 1–11.
8. Increased expssion of the chemokine receptor CXCR3 and its ligand CXCL10 in peripheral airways of smokers with chronic obstructive pulmonary disease / M. Saetta [et al.] // Am. J. Respir. Crit. Care Med. — 2002. — Vol. 165, № 10. — P. 1404–1409.







