В ретроспективном исследовании были изучены клинико-лабораторные параметры 24 новорожденных с массой тела при рождении менее 1000 г и с перивентрикулярными кровоизлияниями(ПВК) 1–2 степени.
Ключевые слова: недоношенные новорожденные, перивентрикулярные кровоизлияния, гипероксия, гипокарбия, артериальное давление, кардиотоническая поддержка
Clinical and laboratory parameters of 24 infants with birth weight less than 1000 grams and periventricular hemorrhage of 1–2 degrees were studied retrospectively.
Keywords: premature infant, periventricular hemorrhage, hypocarbia, hyperoxia, blood pressure, cardiotonic support.
Актуальность. Совершенствование организации перинатальной помощи, материально-техническое оснащение современным оборудованием, а также использование новых технологий первичной реанимации, интенсивной терапии и ухода увеличило число выживших недоношенных детей [3]. В Республике Беларусь выживаемость детей с экстремально низкой массой тела (ЭНМТ) при рождении возросла с 75,3 % в 2012 году до 82,0 % в 2014 году.
Перивентрикулярные кровоизлияния (ПВК) головного мозга относятся к специфическим заболеваниям для данной категории пациентов, встречаются у недоношенных детей с ЭНМТ c частотой от 11 до 40 % и являются важнейшими детерминантами детского церебрального паралича и задержки психического развития [4]. Выявление ранних факторов риска ПВК важно для улучшения стратегий предотвращения неврологической инвалидизации недоношенных детей.
Цель: оценить взаимосвязи клинико-метаболических показателей в раннем неонатальном периоде с развитием ПВК у недоношенных детей с ЭНМТ.
Задача: проанализировать показатели гемодинамики, кардиотонической поддержки, параметры кислотно-основного состояния (КОС) артериальной крови в динамике раннего неонатального периода в зависимости от факта развития ПВК.
Материал и методы. Изучены клинико-лабораторные параметры у 24 детей с ЭНМТ, находившихся на стационарном лечении в отделении анестезиологии и реанимации с палатами интенсивной терапии для новорожденных ГУ РНПЦ «Мать и дитя» в 2013–2014 годах. Единица наблюдения — карта стационарного пациента (форма № 003/у-07). Пациенты были разделены на 2 группы: основную (11 детей с ПВК 1–2 степени) и контрольную (13 детей без ПВК). Критериями включения в группы исследования были: масса тела ребенка при рождении менее 1000 г, гестационный возраст менее 32 недель (224 дня), а также рождение путем операции кесарево сечение для нивелирования влияния фактора родов через естественные родовые пути на развитие ПВК. Критериями исключения из группы исследования были: наличие врожденных пороков развития, хромосомных аномалий, хирургическая патологии, отсутствие контроля инвазивного артериального давления (АД) и данных нейросонографии (НСГ) в раннем неонатальном периоде. ПВК наиболее часто развиваются на протяжении первых 72 часов жизни [1], поэтому первые 120 часов были разделены на 2 периода наблюдения по 6 часов, промежуток с 12-го по 72-й час жизни — на периоды по 12 часов. Промежуток с 4-х по 7-й день жизни был разделен на периоды наблюдения продолжительностью в сутки. Результаты исследования обработаны при помощи программного обеспечения «Statistica 10.0».
Результаты и их обсуждение. Новорожденные исследуемых групп не отличались по полу, массе тела при рождении, сроку гестации, пренатальному применению стероидов, оценке по шкале Апгар на 1-й минуте жизни. Все дети были рождены при помощи операции кесарево сечения для минимизации травматизирующих факторов во время родов через естественные родовые пути на развитие ПВК (см. Табл. 1).
Таблица 1
Общая характеристика исследуемых групп
|
Показатели |
Основная группа (n = 11) |
Контрольная группа (n = 13) |
Метод сравнения, p |
|
Масса тела при рождении, M±SD, г |
856±132 |
856±125 |
ANOVA, p=0,998 |
|
Гестационный возраст, Me(P25-P75), дни |
192(175–217) |
189(189–217) |
Манна-Уитни, p=0,672 |
|
Оценка по шкале Апгар на 1й минуте, Me(P25-P75), баллы |
5(3–6) |
5(5–6) |
Манна-Уитни, p=0,606 |
|
Пренатальная стероидная терапия |
9/2 (81 %) |
12/1 (92 %) |
χ² по Пирсону, p=0,843 |
|
Нуждаемость в ИВЛ/ВЧ ИВЛ |
11/0 |
13/0 |
У детей группы 1 по сравнению с контрольной группой выявлены более высокие показатели парциального напряжения кислорода (pO2) в артериальной крови через 1 час после рождения — 142(117–168) мм.рт.ст. против 84(75,9–95) мм.рт.ст., (p<0,05), а также достоверно большее количество эпизодов гипероксии на протяжении раннего неонатального периода (50 % против 15 %, p<0,05). Таким образом, гипероксия может быть фактором риска развития ПВК. Механизмом повреждающего действия высоких концентраций кислорода, вероятно, является оксидативный стресс, который повреждает эндотелий герминативного матрикса.
Уровень парциального напряжения углекислого газа (pCO2)артериальной крови в основной группе в течение первых 48 часов жизни характеризовался тенденцией к гипокарбии. Статистически значимые межгрупповые различия по этому показателю получены на первом (27,8(26,7–34,4) против 54,8(47,8–59,1) мм.рт.ст., p<0,05) и шестом (28,4(25–29,2) против 37,45(29–45,8) мм. рт. ст., p<0,05) часах жизни.
Минимально допустимые значения гипокарбии, повышаюшие риск развития ПВК у недоношенных новорожденных изучены недостаточно. Однако полученные данные о величинах минимально допустимого pCO2, а также времени, в течение которого они оказывают значимое повреждающее воздействие на мозг недоношенных, соответствуют информации, приведенной в некоторых публикациях [2, 5], где указывается, что у новорожденных с величинами pCO2 менее 30 мм. рт. ст. в первые 48 часов жизни, имеется повышенный риск развития ПВК.
В промежуток между первым и 18-м часами жизни у детей с ПВК по сравнению с детьми контрольной группы наблюдались более высокие средние уровни лактата, выходящие за пределы нормативных значений (см. Рис.1), а также более выраженный дефицит буферных оснований на 1м часу жизни (- 5,75(- 8,65 — (- 5,25) против — 1,5 (- 1,9 — (- 1,2), p<0,05).
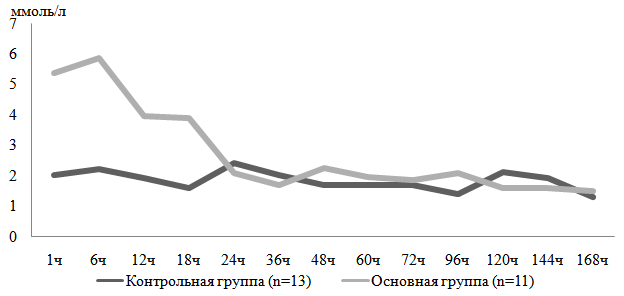
Рис. 1. Концентрация лактата в артериальной крови в динамике раннего неонатального периода
В целом характеристика метаболического блока КОС свидетельствует о развитии более выраженного метаболического ацидоза у детей основной группы.
У детей основной группы выявлены достоверно значимые более низкие значения гликемии на первом часу жизни — 1,55(1–2,1) против 4,5 (3,9–5,3) ммоль/л, p<0,05).
Величина церебрального давления у новорожденных с ЭНМТ во многом детерминирована величиной артериального давления из-за сниженной способности к ауторегуляции церебрального кровотока. Так продолжительность пассивности церебрального кровотока у недоношенных с ЭНМТ достигает 50 % времени суток [3].
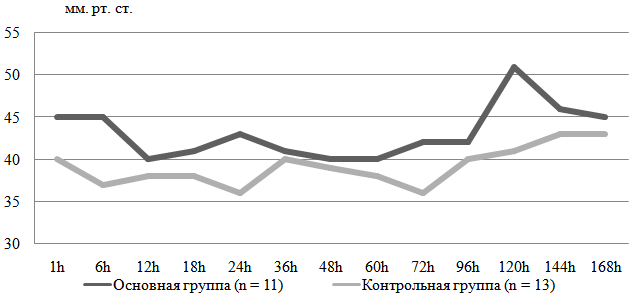
Рис. 1. Среднее артериальное давление (инвазивное) в исследуемых группах
В основной группе отмечен достоверно более высокий уровень среднего артериального давления (инвазивного) по сравнению с контрольной (См. Рис.2), на 1, 6, 24 и 120 часах жизни (p<0,05).
Поддержка гемодинамики у обследованных детей включала назначение дофамина в виде непрерывной инфузии, а при неэффективности последнего — добавление «прямых» кардиотоников (адреналина, норадреналина), также в виде непрерывной инфузии. В кардиотонической терапии нуждались все дети. Непрямые кардиотоники применялись у 3 детей основной группы и у 3 детей — контрольной, достоверных различий в их концентрации и длительности применения выявлено не было. Новорожденным основной группы требовались более высокие дозы дофамина в течение первых 36 часов жизни — 10(7,75–10) против 5 (5–5), (p<0,05).
Также дети основной группы нуждались в большей продолжительности кардиотонии –166(144–192) часов против 72(72–107) часов в контрольной (p<0,05).
Выводы:
У детей с развитием ПВК выявлены:
1. достоверное повышение pO₂ на первом часу жизни а также статистически значимо большее число эпизодов гипероксии в первые сутки жизни, достоверное снижение pCO₂ в первые 6 часов жизни, что предопределяет важность тщательного контроля газов крови;
2. повышение концентрации лактата крови на 1,6,12,18-й часы жизни, снижение актуального избытка оснований в первый час жизни, снижение концентрации глюкозы в первый и 18 час жизни;
3. статистически значимое повышение АД у детей с развитием ПВК в 1-е сутки жизни, что влечет за собой повышение центрального перфузионного давления, и, соответственно, повышает риск развития ПВК;
4. сохранение потребности в дозах дофамина более 10мкг/кг/мин в течение первых трех суток жизни.
Выявленные изменения газов крови, метаболических показателей КОС в течение первых суток жизни, повышение АД в первые сутки, сохранение в потребности в дозах дофамина более 10мкг/кг/мин в течение первых трех суток жизни являются факторами риска развития ПВК у детей с ЭНМТ на 3–4 сутки жизни.
Литература:
1. Барашнев, Ю. И. Перинатальная неврология / Ю. И. Барашнев — Москва: триада — X., 2000. — 640 с.
2. Гнедько Т. В. Программа профилактики тяжелых поражений центральной нервной системы у новорожденных с очень низкой массой при рождении: пособие для врачей анестезиологов-реаниматологов, врачей-неонатологов, врачей-педиатров. / Т. В. Гнедько, А. Н. Витушко ГУ РНПЦ «Мать и дитя». — Минск: Право и экономика, 2013. — 28 с.
3. Avery's Diseases of the Newborn — 9th ed. / Ed.by C. A. Gleason, S. U. Devaskar. — Philadelphia: Elsevier/Saunders, 2012. –1498 P.
4. Lee, J. Y. Risk factors of periventricular-intraventricular hemorrhage in premature infants / J. Y. Lee, Kim H. S. [et al.] // J Korean Med Sci. — 2010. — Vol. 25. — P. 418–424.
5. Erickson, S. J. Hypocarbia in the ventilated preterm infant and its effect on intraventricular hemorrhage and bronchopulmonary dysplasia / S. J. Erickson [et al.] // J. Pediatr Child Healts — 2002 — Vol. 38(6). — P. 119–125.







