Комплексообразование в системе Zr(SO4)2 — лимонная кислота по данным рН-метрии
Авторы: Айсувакова Ольга Павловна, Глушихина Елена Игоревна, Безрядин Сергей Геннадьевич
Рубрика: 4. Неорганическая химия. Комплексные соединения
Опубликовано в
Дата публикации: 25.06.2015
Статья просмотрена: 429 раз
Библиографическое описание:
Айсувакова, О. П. Комплексообразование в системе Zr(SO4)2 — лимонная кислота по данным рН-метрии / О. П. Айсувакова, Е. И. Глушихина, С. Г. Безрядин. — Текст : непосредственный // Современная химия: Успехи и достижения : материалы I Междунар. науч. конф. (г. Санкт-Петербург, июль 2015 г.). — Санкт-Петербург : Свое издательство, 2015. — С. 42-49. — URL: https://moluch.ru/conf/chem/archive/122/8204/ (дата обращения: 24.04.2025).
Методом рН-метрии изучено образование комплексов Zr(IV) c лимонной кислотой в водных растворах. При эквимолярном соотношении реагентов в системе обнаружены комплексы состава 1:1 и 4:4 различной степени протонизации. Показано, что моно- и тетраядерные формы существуют в равновесии во всем изученном диапазоне значений рН. Рассчитаны константы устойчивости и построены графики долевого накопления комплексов.
Ключевые слова: комплексообразование, растворы, рН-метрия, цирконий(IV), лимонная кислота.
Цирконий(IV) образует большое количество комплексных соединений с самыми разнообразными лигандами: карбоновыми кислотами, оксиантрахинонами, ЭДТА, галогенид- и сульфат ионами, β-дикетонами и т. д. Лимонная, винная, яблочная кислоты, препятствующие осаждению ионов циркония(IV) из растворов, являются весьма распространенными маскирующими агентами [1, с. 45]. Комплексы циркония(IV) с полифенолами и оксикарбоксилатными лигандами выполняют функцию высокоселективных реагентов в фотометрическом анализе [2, с. 172]. Однако литературные данные о составе и константах устойчивости многих комплексов циркония (IV) достаточно противоречивы и требуют более тщательно изучения.
Отличительной чертой соединений Zr(IV) является склонность к гидролизу, что приводит к выпадению осадков из водных растворов. Однако некоторые координационные соединения этого элемента относительно устойчивы к гидролизу в водных растворах даже в нейтральной и щелочной среде [3, с. 47]. Цитраты циркония (IV) — предмет настоящего исследования — представляют собой одну из таких групп соединений. Но до настоящего времени ряд вопросов, касающихся полимеризации и гидроксополимеризации ионов Zr(IV) в присутствии оксикарбоновых кислот оставался без должного внимания, хотя гидроксополиядерные соединения представляют большой интерес для решения проблемы смешаннолигандного комплексообразования в целом. Поэтому в задачу настоящего исследования входило изучение процессов образования моно- и полиядерных комплексов циркония(IV) c лимонной кислотой в широком диапазоне концентраций рН, ионов металла и лиганда.
Объектами исследования являлись комплексы Zr (IV) с лимонной кислотой (H4Cit). В качестве источника циркония(IV) использовался сульфат циркония (IV), полученный из оксохлорида циркония(IV) ZrOCl2·8H2O «хч», который очищался от примесей перекристаллизацией из 25 %-ного раствора соляной кислоты [4, с. 1470]. Лимонная кислота квалификации «чда» использовалась без дополнительной очистки. Стандартизацию раствора сульфата циркония проводили комплексонометрически с ксиленоловым оранжевым [5, с. 109]. Точную концентрацию лиганда определяли титрованием стандартным раствором гидроксида натрия в присутствии тимолового синего [6, с. 186].
Для получения однозначной модели комплексообразования и выявления полиядерных комплексных форм нами исследован широкий диапазон концентраций 0.0013–0.0200 моль/л по металлу и 0.0014–0.0210 моль/л по лиганду для следующих соотношений реагентов 1:1. Моделирование равновесий в системе Zr(SO4)2 — лимонная кислота проводилось на основании данных рН-метрического титрования. Так как равновесие в исследуемой системе устанавливается быстро, для изучения реакций комплексообразования использовался метод непрерывного титрования (титрование длится несколько часов; время установления воспроизводимых значений стеклянного электрода — не более 15 мин). Изучение комплексообразования в системе проводили в среде аргона. Активность протонов определяли на рН-метре «pH 213» (Hanna Instruments, USA) с точностью 0.005 ед. pH. Температуру рабочих растворов поддерживали на уровне t = 25 ± 0.1 0С.
Для моделирования равновесий в системе цирконий(IV) — лимонная кислота использовался программный продукт CPESSP [7, с. 30]. Достоверность полученных результатов оценивали по критерию Фишера Fpr.
Формирование выборки начинали с модели, включающей комплексы состава 1:1. Затем уточняли модель введением элементов 2:2 и 4:4. Для расчета использовали литературные значения констант образования гидроксокомплексов циркония(IV) [8, с. 94] и констант диссоциации лимонной кислоты [9, с. 237].
На рисунке 1 приведены зависимости функции Бъеррума ñ [10, с. 68] от рН при различных концентрациях ионов металла и лиганда. Как видно из представленных кривых величина функции Бъеррума при фиксированном значении рН в кислой, нейтральной и слабощелочной области увеличивается с ростом концентрации циркония. Такое поведение кривых можно объяснить образование комплексных форм различной ядерности.
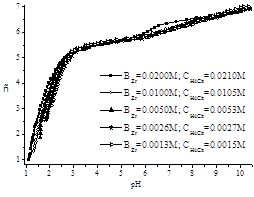
Рис 1. Зависимость функции Бьеррума от рН в системе Zr(IV) — лимонная кислота при соотношении реагентов 1:1 (ВZr = 0.0013–0.0200М, CH4Cit=0.0015–0.0210М)
При составлении модели комплексообразования в системе Zr(IV) — лимонная кислота в качестве исходных были выбраны следующие ранее приводимые в литературе комплексы [11, с. 253; 12, с. 24]: [ZrHCit]+, [ZrCit]0, [Zr4(OH)3(Cit)4]3-, [Zr4(OH)4(Cit)4]4-, [Zr4(OH)5(Cit)4]5-, [Zr4(OH)6(Cit)4]6-. Матрица стехиометрии для эквимолярного соотношения реагентов, составленная по литературным данным, не удовлетворительно описывает полученные нами экспериментальные кривые (R-фактор — величина, характеризующая отклонение теоретически рассчитанных значений функции Бъеррума от полученных экспериментально — превышает 7 %). Поэтому приводимые в литературе модели была дополнена нами моно- и тетраядерными формами состава [Zr(OH)2Cit]2-, [Zr(OH)3Cit]3-, [Zr(OH)4Cit]4-, [Zr4(HCit)3(Cit)]3+, [Zr4(Cit)4]0, [Zr4(OH)10(Cit)4]10-, [Zr4(OH)11(Cit)4]11-, [Zr4(OH)12(Cit)4]12-. Тетраядерные комплексы вносят ощутимый вклад в меру качества модели.
Проверка предположения о возможном образовании протонированных моноядерных комплексов [ZrH3Cit]+ и [ZrH2Cit]2+ и комплекса, содержащего полностью диссоциированную форму лиганда [ZrCit]0, показала, что подобные частицы в изучаемой системе не образуются. Взаимодействие ионов циркония с лимонной кислотой начинается с образования в кислой области комплекса [ZrHCit]+, причем максимальная доля накопления этой формы достигает 60 %. Параллельно идет процесс полимеризации, и уже в кислой области (рН 2–3) зафиксировано существование тетраядерных частиц различной степени депротонизации ([Zr4(HCit)3(Cit)]3+, [Zr4(Cit)4]0).
Гидролитический распад цитратов циркония (IV) начинается уже в кислой среде. В диапазоне рН 3–6 становится значимым вклад в комплексообразование смешаннолигандных (гидроксоцитратных) комплексов состава [Zr4(OH)3(Cit)4]3-, [Zr4(OH)6(Cit)4]6-, [Zr4(OH)8(Cit)4]8-. Доля накопления моноядерного анионного комплекса [Zr(OH)2Cit]6- достигает величины 75 %, а диапазон существования данной частицы охватывает кислую, нейтральную и слабощелочную области (рН 3–8). В щелочной области (рН 7,5–10,5) обнаружены тетраядерные частицы [Zr4(OH)10(Cit)4]10-, [Zr4(OH)11(Cit)4]11-, [Zr4(OH)12(Cit)4]12- (доля накопления — 50, 20 и 15 % соответственно) и моноядерные комплексы [Zr(OH)3Cit]7- и [Zr(OH)4Cit]8- (60 и 10 % соответственно).
Таким образом, во всем изученном диапазоне значений рН моно- и тетраядерные формы существуют в равновесии. Константы устойчивости обнаруженных комплексных форм приведены в таблице 1.
Таблица 1
Состав и константы устойчивости цитратов циркония(IV)
|
№ |
Комплекс |
lgβ |
|
|
1 |
[ZrHCit]+ |
13.08 |
|
|
2 |
[Zr(OH)2Cit]2- |
47.82 |
|
|
3 |
[Zr(OH)3Cit]3- |
54.19 |
|
|
4 |
[Zr(OH)4Cit]4- |
57.47 |
|
|
5 |
[Zr4(HCit)3(Cit)]3+ |
70.82 |
|
|
6 |
[Zr4(Cit)4]0 |
107.9 |
|
|
7 |
[Zr4(OH)3(Cit)4]3- |
143.81 |
|
|
8 |
[Zr4(OH)6(Cit)4]6- |
177.99 |
|
|
9 |
[Zr4(OH)8(Cit)4]8- |
197.14 |
|
|
10 |
[Zr4(OH)10(Cit)4]10- |
212.86 |
|
|
11 |
[Zr4(OH)11(Cit)4]11- |
218.37 |
|
|
12 |
[Zr4(OH)12(Cit)4]12- |
223.09 |
На основании этих данных построены диаграммы распределения комплексных частиц в системе Zr(IV) — лимонная кислота (рис. 2).
Предложенная нами схема комплексообразования в системе Zr(IV) — лимонная кислота учитывает образование моно- и полиядерных частиц состава 1:1 и 4:4 различной степени протонизации. Доминирующими комплексными частицами в растворе являются тетраядерные формы, описывающие как кислую, так и щелочную области, начиная с рН 2. Доля накопления протонированной моноядерной формы [ZrHCit]+ невелика, данная частица существует лишь в сильнокислой области при рН<2. Наличие целого ряда комплексных форм различной ядерности, по-видимому, объясняется как свойствами лиганда, так и тенденцией ионов циркония(IV) к образованию полиядерных частиц в растворах [3, с 52; 13, с. 1041; 14, с. 880].
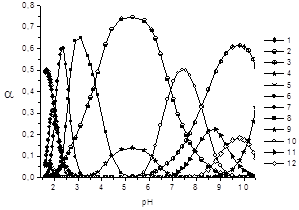
Рис. 2. Графики долевого накопления комплексных форм в системе Zr(IV)- лимонная кислота от рН: B(Zr)= 0.0050М: C(H4Cit)= 0.0053M: 1 — [ZrHCit]+; 2 — [Zr(OH)2Cit]2-; 3 — [Zr(OH)3Cit]3-; 4 — [Zr(OH)4Cit]4-; 5 — [Zr4(HCit)3Cit]3+; 6 — [Zr4(Cit)4]0; 7 — [Zr4(OH)3(Cit)4]3-; 8 — [Zr4(OH)6(Cit)4]6-; 9 — [Zr4(OH)8(Cit)4]8-; 10 — [Zr4(OH)10(Cit)4]10-; 11 — [Zr4(OH)11(Cit)4]11-; 12 — [Zr4(OH)12(Cit)4]12-
Способность цитрат-ионов к образованию тетраядерных комплексов может объясняться связываем цитратных остатков с ионами металлов через α-гидроксильную группу лиганда [17, с 141; 18, с.]. В работе Журавлевой Н. В. [18, с. 91], однако, отмечают, что для полиядерного комплесообразования недостаточно связывания ионов металлов лишь посредством α-гидроксильной группы, в образовании полиядерных циртатов также должны участвовать карбоксильные группы лиганда. При этом возможна реализация максимальной дентатности лиганда, равной четырем.
Литература:
1. Пятницкий, И. В. Маскирование и демаскирование в аналитической химии / И. В. Пятницкий, В. В. Сухан. — М.: Наука, 1990. — 222 с.
2. Коростелев, П. П. Фотометрический и комплексонометрический анализ в металлургии / П. П. Коростелев. — М.: Металлургия, 1984. — 272 с.
3. Ekberg, C. Studies on the hydrolytic behavior of zirconium(IV) / C. Ekberg, G. Kallvenius, Y. Albinsson, P. Brown //J. Solution Chem. — 2004. — V. 33, № 1. — P. 47–79.
4. Брауэр, Г. Руководство по неорганическому синтезу: в 6 томах. Т.4. / Г. Брауэр, Ф. Вайгель, Х. Кюнль, У. Ниман, Х. Пуфф, Р. Сиверс, А. Хаас, И. Хелмбрехт, П. Эрлих. — М.: Мир. 1985. — 1501 с.
5. Елинсон, С. В. Аналитическая химия циркония и гафния / С. В. Елинсон, К. И. Петров. — М.: Наука, 1965. — 241 с.
6. Лурье, Ю. Ю. Справочник по аналитической химии / Ю. Ю. Лурье. — М.: Химия, 1989. — 448 с.
7. Сальников, Ю. И. Полиядерные комплексы в растворах / Ю. И. Сальников, А. Н. Глебов, Ф. В. Девятов. — Казань: Изд-во Казанского ун-та, 1989. — 288 с.
8. Назаренко, В. А. Гидролиз ионов металлов в разбавленных растворах / В. А. Назаренко, В. П. Антонович, Е. М. Невская. — М.: Атомиздат, 1979. — 192 с.
9. Кочергина, Л. В. Термохимическое исследование реакций кислотно-основного взаимодействия в водном растворе лимонной кислоты / Л. В. Кочергина, В. П. Васильев, Д. В. Крутов, О. Н. Крутова. // Журн. физ. химии. — 2007. — Т. 81, № 2. — С. 234–238.
10. Бек, М. Исследование комплексообразования новейшими методами / М. Бек, И. Надьпал. — М.: Мир, 1989. — 431 с.
11. Чевела, В. В. Цитраты циркония(IV) в водных растворах / В. В. Чевела, С. Г. Безрядин, В. Ю. Иванова, Л. И. Мухамедьярова, Н. А. Григорьева, В. С. Залымов, Л. Г. Смирнова // Ученые записки казанского университета. Серия Естественные науки. — 2010. — Т.152, Кн.4. — С. 251–254.
12. Мухамедьярова, Л. И. Состав, структура и устойчивость цитратов циркония(IV) в водных растворах / Л. И. Мухамедьярова, С. Г. Безрядин, В. В. Чевела, Н. А. Григорьева, В. С. Залымов, В. Ю. Иванова // Вестник Оренбургского государственного университета. — 2010. — Т.118, № 12. — С. 22–26.
13. Dehnicke, K. Existence of the VO2+, TiО2+ and ZrО2+ сations / К. Dehnicke, J. Weidlein // Angew. Chem. Int. Ed. — 1996. — V. 5, № 12. — P. 1041.
14. Канажевский, В. В. Изменение локального окружения циркония при замещении лигандов в растворах / В. В. Канажевский, В. П. Шмачкова, Н. С. Коцаренко, В. Н. Коломийчук, Д. И. Кочубей. // Журн. структ. химии. — 2006. — Т. 47, № 5. — С.874–881.
15. Blomqvist, K. Solution study of system with polynuclear complex formation. 4. Heteronuclear copper(II) citrate complexes with nickel(II) or magnesium(II) / K. Blomqvist, E. R. Still // Inorg. Chim. Acta, 1984 — V. 82, № 2. — P. 141–144.
16. Журавлева, Н. Е. Гомо- и гетерополиядерные координационные соединения 4f-ионов иттриевой группы и некоторых 3d-ионов в цитратных водных растворах / Н. Е. Журавлева // дисс… канд. хим. наук. … 02.00.01 / Журавлева Наталья Евгеньевна. — Казань, 1986. — 214 с.
Похожие статьи
Синтез и спектральные характеристики комплексов 1,3-дифенилтриазенов меди, марганца и кобальта
Синтезированы комплексные соединения 1,3-дифенилтриазенов меди, марганца и кобальта. Методами ИК-, электронной спектроскопии, химического, рентгенфазового и термогравиметрического анализов изучен состав и строение полученных комплексов. В соответстви...
Исследование комплексообразования мeди (II) С 2,6-дитиол-фенолом и гидрофобными аминами
Спектрофотометрическими методами исследовано комплексообразование меди с 2,6-дитиолфенолом (ДТФ) и гидрофобными аминами (Ам). В качестве гидрофобного амина использован анилин (Ан), N-метиланилин (мАн), и N,N-диметиланилин (дАн). Было установлено, что...
Синтез и исследование структуры и свойств комплексных соединений двухвалентного марганца со смешанными лигандами (2-амино-3-гидроксипропионовая кислота и карбамид)
Синтезировали сложные комплексы марганца (II) с серин и карбамид (L1-серин (C3H7NO3), L2-karbamid ((NH2) CO), [MnL1L2Cl2], [MnL1L2(H2O)2]Cl2, в различных средах. С помощью химического, ИК-спектрального и термогравиметрического анализа установлены сос...
Амперометрическое комплексиметрическое титрование ионов некоторых благородных металлов и ртути(II) тионалидом и тиомочевиной
Показана возможность титрования некоторых благородных металлов и ртути. Установлено что при образовании комплексов тионалид и тиомочевины с исследованными нами металл в конечной точке титрования их молярное соотношение с реагентами 1:1 для Ag+, 1:2 P...
Кинетика пероксидазного окисления гидрохинона перекисью водорода
Спектрофотометрическим методом изучена кинетика пероксидазного окисления гидрохинона перекисью водорода в зависимости от концентрации субстратов и рН растворов. Установлено, что ферментативная реакция имеет первый порядок по перекиси водорода в диап...
Влияние природы катионов переходных элементов на каталитические свойства цеолита типа CaY в реакции алкилирования о-ксилола третбутанолом
Изучено алкилирование о-ксилола трет-бутанолом на цеолитах типа У модифицированных переходными элементами. Установлена высокая активность цеолитных катализаторов содержащих два многозарядных катиона (FeCaNaY, CrCoCaNaY и CoCaNaY) и показано, что пере...
Эффект влияния концентрации оксида магния на физико-химические и каталитические свойства высококремнеземных цеолитов типа ЦВМ в реакции алкилирования толуола изопропанолом
Изучено влияние концентрации магния на физико-химические и каталитические свойства НЦВМ в реакции алкилирования толуола изопропанолом. На основании данных полученных методами ТПД аммиака и ВЕТ, показано, что в результате химического модифицирования п...
Закономерности превращения этанола на пентасилах
В интервале температур 300–4000С в проточной установке со стационарным слоем катализатора при атмосферном давлении изучено влияние мольного отношения SiO2/Al2O3 на концентрацию кислотных центров, распределение продуктов и направление реакций при прев...
Исследование окислительной активности хлорсодержащих окислителей
В работе представлен анализ возможных химических процессов, протекающих в растворах кислородсодержащих соединений хлора. Рассмотрены возможные формы существования хлорсодержащих соединений в зависимости от кислотности среды растворов. Проанализирован...
Установление состава комплекса по методу изомолярных серий при определении золота
В работе изучено комплексообразование золота(III) с азореагентом и установлена зависимость оптической плотности от pH среды, концентрации реагирующих компонентов, состава буферных растворов, определен состав комплекса Me:R, молярный коэффициент свето...
Похожие статьи
Синтез и спектральные характеристики комплексов 1,3-дифенилтриазенов меди, марганца и кобальта
Синтезированы комплексные соединения 1,3-дифенилтриазенов меди, марганца и кобальта. Методами ИК-, электронной спектроскопии, химического, рентгенфазового и термогравиметрического анализов изучен состав и строение полученных комплексов. В соответстви...
Исследование комплексообразования мeди (II) С 2,6-дитиол-фенолом и гидрофобными аминами
Спектрофотометрическими методами исследовано комплексообразование меди с 2,6-дитиолфенолом (ДТФ) и гидрофобными аминами (Ам). В качестве гидрофобного амина использован анилин (Ан), N-метиланилин (мАн), и N,N-диметиланилин (дАн). Было установлено, что...
Синтез и исследование структуры и свойств комплексных соединений двухвалентного марганца со смешанными лигандами (2-амино-3-гидроксипропионовая кислота и карбамид)
Синтезировали сложные комплексы марганца (II) с серин и карбамид (L1-серин (C3H7NO3), L2-karbamid ((NH2) CO), [MnL1L2Cl2], [MnL1L2(H2O)2]Cl2, в различных средах. С помощью химического, ИК-спектрального и термогравиметрического анализа установлены сос...
Амперометрическое комплексиметрическое титрование ионов некоторых благородных металлов и ртути(II) тионалидом и тиомочевиной
Показана возможность титрования некоторых благородных металлов и ртути. Установлено что при образовании комплексов тионалид и тиомочевины с исследованными нами металл в конечной точке титрования их молярное соотношение с реагентами 1:1 для Ag+, 1:2 P...
Кинетика пероксидазного окисления гидрохинона перекисью водорода
Спектрофотометрическим методом изучена кинетика пероксидазного окисления гидрохинона перекисью водорода в зависимости от концентрации субстратов и рН растворов. Установлено, что ферментативная реакция имеет первый порядок по перекиси водорода в диап...
Влияние природы катионов переходных элементов на каталитические свойства цеолита типа CaY в реакции алкилирования о-ксилола третбутанолом
Изучено алкилирование о-ксилола трет-бутанолом на цеолитах типа У модифицированных переходными элементами. Установлена высокая активность цеолитных катализаторов содержащих два многозарядных катиона (FeCaNaY, CrCoCaNaY и CoCaNaY) и показано, что пере...
Эффект влияния концентрации оксида магния на физико-химические и каталитические свойства высококремнеземных цеолитов типа ЦВМ в реакции алкилирования толуола изопропанолом
Изучено влияние концентрации магния на физико-химические и каталитические свойства НЦВМ в реакции алкилирования толуола изопропанолом. На основании данных полученных методами ТПД аммиака и ВЕТ, показано, что в результате химического модифицирования п...
Закономерности превращения этанола на пентасилах
В интервале температур 300–4000С в проточной установке со стационарным слоем катализатора при атмосферном давлении изучено влияние мольного отношения SiO2/Al2O3 на концентрацию кислотных центров, распределение продуктов и направление реакций при прев...
Исследование окислительной активности хлорсодержащих окислителей
В работе представлен анализ возможных химических процессов, протекающих в растворах кислородсодержащих соединений хлора. Рассмотрены возможные формы существования хлорсодержащих соединений в зависимости от кислотности среды растворов. Проанализирован...
Установление состава комплекса по методу изомолярных серий при определении золота
В работе изучено комплексообразование золота(III) с азореагентом и установлена зависимость оптической плотности от pH среды, концентрации реагирующих компонентов, состава буферных растворов, определен состав комплекса Me:R, молярный коэффициент свето...











