Анальгетическая, противомикробная и жаропонижающая активность метиловых эфиров 3-ацил -5-циано-4h-пиран-2-карбоновых кислот
Авторы: Давыдова Вера Владимировна, Данилова Мария Валерьевна, Марьясов Максим Андреевич, Шевердов Владимир Петрович, Насакин Олег Евгеньевич
Рубрика: 9. Биологическая химия
Опубликовано в
II международная научная конференция «Современная химия: Успехи и достижения» (Чита, апрель 2016)
Дата публикации: 06.04.2016
Статья просмотрена: 163 раза
Библиографическое описание:
Анальгетическая, противомикробная и жаропонижающая активность метиловых эфиров 3-ацил -5-циано-4h-пиран-2-карбоновых кислот / В. В. Давыдова, М. В. Данилова, М. А. Марьясов [и др.]. — Текст : непосредственный // Современная химия: Успехи и достижения : материалы II Междунар. науч. конф. (г. Чита, апрель 2016 г.). — Чита : Издательство Молодой ученый, 2016. — С. 42-45. — URL: https://moluch.ru/conf/chem/archive/162/10216/ (дата обращения: 03.04.2025).
Нами в рамках проведения работ по гранту РНФ № 15–13–10029 синтезированы цианопроизводные пиранов, а именно метил 3-ацил-6-амино-4-арил-5-циано-4H-пиран-2-карбоксилатов [1–3], по реакциям взаимодействия метиловых эфиров 2,4-диоксобутановых кислот с 2-арилиденмалононитрилами и изучена их биологическая активность.
Полученные соединения I, II представляют собой кристаллические вещества белого цвета, с высокими температурами плавления. Их строение доказано на основании данных ИК, ЯМР-1Н, 13C и масс-спектров.
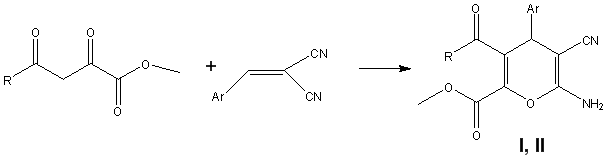
Ar = 3,4,5-(MeO)3C6H2 (I), 4-MeOCOC6H4 (II); R = CH3 (Ia, IIe), 4-MeOC6H4 (Ib, IIa), 2-Fu (Ic, IIc), 2-Thienyl (Id, IId), 3,4-(MeO)2C6H3 (IIb), 4-MeC6H4 (IIf)
Бактериостатическую активность соединений I, II оценивали по величине минимальной подавляющей концентрации (МПК) в мкг/мл, которая задерживала рост бактериальных культур. МПК для полученных соединений во всех случаях составила 1000 мкг/мл. Для соединения IIa обнаружена высокая анальгетическая активность.
Жаропонижающее действие оценивали по уменьшению гипертермии через 30 мин, 1, 2 и 3 часа после введения исследуемого вещества беспородным белым крысам обоего пола. В качестве препарата сравнения использовали ацетилсалициловую кислоту в дозе 50 мг/кг при в/б введении. Среди изученных соединений соединение IIс показало активность, превысившую действие препарата сравнения.
Влияние на антителогенез для соединений II оценивали по числу антителобразующих клеток (АОК). Вещества исследовали в концентрациях 50 мг/кг.При анализе влияния соединений на количество АОК было обнаружено статистически значимое угнетающее влияние на количество АОК в селезёнке мышей у соединений IIa, IIb, IIeи IIf. Таким образом,данные соединения снижают выраженность антителогенеза и угнетают гуморальный иммунный ответ.
По результатам биологических испытаний можно заключить, что средиметил 3-ацил-6-амино-4-арил-5-циано-4H-пиран-2-карбоксилатов возможен поиск биологически активных веществ с анальгетическим, жаропонижающим и иммуносупрессивным действием.
Экспериментальная биологическая часть
Полученные соединения были подвергнуты испытаниям на различные виды биологической активности.
Антимикробную активность определяли методом серийных разведений в жидкой питательной среде исследуемого соединения и изучали активность по отношению к грамотрицательным бактериям — кишечная палочка (E. Coli 25922 АТСС) и грамположительным бактериям — золотистый стафилококк (St. Аureus 65338Р АТСС) [4]. Вещества растворяли в диметилформамиде в соотношении 1:100 и затем разводили мясопептонным бульоном (МПБ). Рабочий раствор готовили разведением бактериальной культуры с концентрацией 5 млн. микробных клеток в 1мл, который в количестве 0,1 мл вносили в 2 мл МПБ. В результате бактериальная нагрузка на 1 мл культуральной жидкости составляла 250 000 микробных клеток. Результаты опытов оценивали после 18–20 часов выдержки контрольных и опытных образцов в термостате при температуре 36–37ºС. Регистрировали наличие роста бактериальных культур или торможения за счет бактериостатического действия соединений. Бактериостатическую активность соединений оценивали по величине минимальной подавляющей концентрации (МПК) в мкг/мл, которая задерживала рост бактериальных культур. МПК для полученных соединений по отношению к обоим штаммам во всех случаях составила 1000 мкг/мл, что свидетельствует об отсутствии выраженной активности.
Анальгетическую активность соединений II изучали на белых мышах массой 16–22 г. методом «горячая пластинка» [5]. Животным вводили исследуемые вещества в дозе 50 мг/кг в 2 % растворе крахмальной слизи внутрибрюшинно (в/б). Контрольным мышам вводили эквиобъемные количества крахмальной слизи. Время развития оборонительного рефлекса (отдергивания лапок) оценивали через 1 час после введения веществ. Регистрировали время с момента помещения животного на горячую поверхность (температура 50 0С) до появления поведенческого ответа мыши — отдергивания задней лапы [4] (табл.). Статистическую обработку эксперимента проводили с использованием критерия Стьюдента. Эффект считали достоверным при р<0,05. Наиболее активным оказалось соединение IIa, что частично можно объяснить лучшей растворимостью данного соединения и, вероятно, более высокой биологической доступностью.
Исследования жаропонижающей активности проводили на беспородных белых крысах обоего пола, массой 220–280 грамм, лихорадочную реакцию вызывали внутримышечным введением пирогенала в дозе 400 мг/кг. Ректальную температуру измеряли цифровым электротермометром OMRON Eco Temp (МС-203-Е) до введения пирогенала (исходная температура) и через 3 часа после него (разница этих измерений представляет собой оцениваемую гипертермическую реакцию). Исследуемые вещества вводили в/б в дозе 50 мг/кг через 3 часа после введения пирогенала, т. е. на пике гипертермии. Жаропонижающее действие оценивали по уменьшению гипертермии через 30 мин, 1, 2 и 3 часа после введения исследуемого вещества. В качестве препарата сравнения использовали ацетилсалициловую кислоту в дозе 50 мг/кг при в/б введении (табл.). Среди изученных соединений только соединение IIс показало активность, превысившую действие препарата сравнения.
Влияние на антителогенез для соединений II оценивали по числу антителобразующих клеток (АОК). Вещества исследовали в концентрациях 50 мг/кг. Вещества суспендировали в 2 % крахмальной слизи и вводили мышам в/б. В качестве контроля вводили 2 % крахмальную слизь. Через 1 час животных всех групп иммунизировали эритроцитами барана в концентрации 108 кл/0,2 мл в/б. На 5-е сутки животных выводили из эксперимента путем декапитации под эфирным наркозом.
Селезенку помещали в заранее приготовленную полную питательную среду 199 с добавлением 10 мM HEPES (“Sigma”), 2 мM L-глутамина (“Sigma”). Затем орган осторожно гомогенизировали в стеклянном или пластиковом гомогенизаторе одним-двумя вертикальными движениями пестика. Полученную клеточную суспензию фильтровали через два слоя капроновой сетки. Подсчет клеточности каждой селезенки проводили в 25 маленьких квадратах камеры Горяева.
Для изучения интенсивности гуморального ответа на эритроциты барана использовали метод локального гемолиза в геле агарозы [6]. Готовили 0,75 % золь агарозы марки Б (Олайнский завод химреактивов) на растворе Хенкса, разливали его в пробирки по 2,5 мл и охлаждали до 470С в ультротермостате. Затем в пробирку вносили рабочий объем клеток (рассчитывался в предварительных опытах таким образом, чтобы количество образующихся зон гемолиза колебалось от 50 до 500 на чашку; этот объем был разным для различных клеточных суспензий) и 0,025 мл эритроцитов барана (концентрация эритроцитов при этом колебалась от 50 до 100 млн в 1 мл геля). Смесь быстро перемешивали и вносили по 2,5 мл на предварительно подогретые до 400С чашки Петри. После застывания геля агарозы чашки инкубировали при 37оС в течение 1 часа. Затем добавляли 2,5 мл комплемента (производство НПО «Биомед», ампула лиофилизированного комплемента разводилась в 5 мл среды 199). Через 1 час инкубации при 370C комплемент сливали. Число зон гемолиза, каждая из которых соответствует одной IgM-АОК, подсчитывали при боковом освещении. Результаты, учитывая log-нормальное распределение данных выражали в виде log10 АОК на весь орган [7] (табл.).
При анализе влияния соединений на количество антителообразующих клеток было обнаружено статистически значимое угнетающее влияние на количество антителообразующих клеток в селезёнке мышей у соединений IIa, IIb, IIe и IIf. Таким образом, данные соединения снижают выраженность антителогенеза и угнетают гуморальный иммунный ответ.
По результатам биологических испытаний можно заключить, что среди метил 3-ацил-6-амино-4-арил-5-циано-4H-пиран-2-карбоксилатов возможен поиск биологически активных веществ с анальгетическим, жаропонижающим и иммуносупрессивным действием.
Таблица
Биологическая активность исследуемых соединений
|
Соединение |
Анальгетическая активность |
Влияние на антителогенез |
Жаропонижающая активность |
|||
|
Отдергивание лапы, сек |
Число антителообразующих клеток вселезёнке (млн/орг) |
Изменение температуры (0С) под влиянием изучаемых веществ |
||||
|
0,5 ч |
1 ч |
2 ч |
3 ч |
|||
|
Контроль |
14 |
56098,72 |
39,3±0,21 (+0,6) |
39,4±0,19 (+0,7) |
39,5±0,39 (+0,8) |
39,4±0,32 (+0,7) |
|
IIa |
19 |
14153,28* |
37,4±0,72 (-0,5) Р >0,05 |
37,6±0,75 (+0,2) Р >0,05 |
38,6±0,53 (+1,2) Р >0,05 |
39,2±0,28 (+1,7) Р <0,05 |
|
IIb |
14,5 |
9350* |
37,4±0,58 (-0,2) Р >0,05 |
37,7±0,28 (+0,2) Р>0,05 |
38,3±0,61 (+0,7) Р >0,05 |
38,8±0,49 (+1,2) Р <0,05 |
|
IIc |
14 |
33349,33 |
37,6±0,06 (-0,5)* Р >0,05 |
37,7±0,12 (-0,4)* Р >0,05 |
37,8±0,11 (-0,3)* Р >0,05 |
38,1±0,06 (0)* Р >0,05 |
|
IId |
13,75 |
34619,4 |
37,1±0,35 (-0,3) Р >0,05 |
37,2±0,35 (-0,2) Р >0,05 |
38,2±0,32 (+0,8) Р >0,05 |
38,4±0,15 (+1,0) Р >0,05 |
|
IIe |
15 |
12783,2* |
37,0±0,10 (-0,5) Р >0,05 |
37,2±0,21 (-0,3) Р <0,05 |
37,7±0,05 (+0,2) Р >0,05 |
38,3±0,50 (+0,8) Р >0,05 |
|
IIf |
14,75 |
10860,53* |
37,2±0,20 (-0,4) Р <0,05 |
37,6±0,38 (0) Р <0,05 |
38,1±0,38 (+0,5) Р <0,05 |
38,6±0,38 (+1,0) Р >0,05 |
|
Метамизол натрия (93 мг/кг) |
16 |
- |
- |
- |
- |
- |
|
Ацетилсалициловая к-та |
- |
- |
37,6±0,32 (-0,2) Р < 0,01 |
37,7±0,57 (-0,1) Р >0,05 |
38,3±0,80 (+0,5) Р >0,05 |
38,6±0,15 (+0,8) Р >0,05 |
*Соединения с выраженной активностью
Литература:
- В. П. Шевердов, А. Ю. Андреев, О. В. Ершов и др., Xимия гетеpоцикл. cоедин., № 7, 1073–1082 (2012).
- В. П. Шевердов, А. Ю. Андреев, О. Е. Насакин, В. Л. Гейн, Химико-фармацевтический журнал, 48, № 6, 25 − 28 (2014).
- Шевердов В. П., Насакин О. Е., Андреев А. Ю., Гейн В. Л., Тафеенко В. А. Журнал органической химии, 47, вып.7, 1097–1098 (2011).
- Р. У. Хабриев (ред.) Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, Медицина, Москва, (2005).
- А. Н. Миронов (ред.) Руководство по проведению клинических исследований лекарственных средств. Часть первая, Гриф и К, Москва, (2012).
- N. K. Jerne and A. A. Nordin, Science, 140, 405–408 (1963).
- В. П. Лозовой, В. В. Губарев, Е. Н. Наумова, Т. В. Елисеева, Иммунология, № 2, 50–53 (1989).
Похожие статьи
Синтез и квантово-химические характеристики нового азокрасителя
Разработан способ синтеза 2-метилфенил-азо-4-гидрокси-6-бромофенил-карбокси-3 и изучены его квантово-химические характеристики.
Похожие статьи
Синтез и квантово-химические характеристики нового азокрасителя
Разработан способ синтеза 2-метилфенил-азо-4-гидрокси-6-бромофенил-карбокси-3 и изучены его квантово-химические характеристики.











