Цитостатики на основе циансодержащих гетероциклов
Авторы: Давыдова Вера Владимировна, Данилова Мария Валерьевна, Марьясов Максим Андреевич, Шевердов Владимир Петрович, Насакин Олег Евгеньевич
Рубрика: 9. Биологическая химия
Опубликовано в
II международная научная конференция «Современная химия: Успехи и достижения» (Чита, апрель 2016)
Дата публикации: 06.04.2016
Статья просмотрена: 145 раз
Библиографическое описание:
Цитостатики на основе циансодержащих гетероциклов / В. В. Давыдова, М. В. Данилова, М. А. Марьясов [и др.]. — Текст : непосредственный // Современная химия: Успехи и достижения : материалы II Междунар. науч. конф. (г. Чита, апрель 2016 г.). — Чита : Издательство Молодой ученый, 2016. — С. 45-47. — URL: https://moluch.ru/conf/chem/archive/162/10217/ (дата обращения: 28.04.2025).
Рак остается одной из наиболее серьезных заболеваний человечества. Онкологические заболевания являются одной из основных причин смерти во всем мире. По прогнозам, число случаев смерти от онкологических заболеваний в мире будет продолжать расти и в 2030 году достигнет 12 миллионов случаев смерти. В связи с этим, синтез новых соединений и создание на их основе противоопухолевых препаратов, обладающих улучшенными фармакокинетическими свойствами, является актуальной задачей.
Несмотря на появление новых противоопухолевых лекарств, их клиническая эффективность недостаточна, а спектр онкологических заболеваний, чувствительных к химиотерапии, ограничен. В связи с этим не теряет актуальности вопрос поиска новых химических соединений с противоопухолевыми свойствами как основы для последующей разработки более эффективных лекарств. Основными критериями для отбора новых соединений являются: уникальность химической структуры, новый механизм действия, избирательная цитотоксичность, высокая противоопухолевая активность invivo, доступность для производства.
Наземные растения были использованы в качестве лекарственных средств в Египте, Китае, Индии и Греции с древнейших времен и большое количество современных препаратов, разработано с ними в наше время. Первые письменные упоминания о целебных возможностях использования растений появились примерно в 2600 г. до н. э. у шумеров и Аккадцев (Самуэльсон, 1999). В «Папирусе Эберса», самым известным египетским фармацевтическим справочнике, в котором зафиксировано более 700 препаратов, представляет собой историю египетской медицины датированный около 1500 г. до н. э.
Определенное место в этих рецептурах занимали растения, содержащие цианогенные глюкозиды. Цианогенные гликозиды — это группа нитрилсодержащих растительных вторичных соединений, которые выделяют цианид (цианогенез) после их ферментативного расщепления. Хотя есть много природных источников цианида, в том числе растения, бактерии и грибы. Цианогенные глюкозиды были зарегистрированы в более чем 2650 видах высших растений, распределенных среди 130 семейств. Самым известным цианогенным глюкозидом является амигдалин. Он был впервые выделен в 1830 году французскими химиками и использовался в качестве противоракового средства в России уже в 1845 г. Первое использование амигдалина в Соединенных Штатах для лечения рака произошло в начале 1920-х годов.
Выделение алкалоидов барвинка — винбластина и винкристина представила новую эру использования растительных материалов. Эти алкалоиды содержат гидроксильные, метоксильные, метоксикарбонильные функциональные группы. Представляются актуальными также работы по синтезу и исследованию свойств куркумина, колхицина и производных, содержащих эти фрагменты. Ранее было установлено, что синтезированные нами полицианозамещенные карбо- и гетероциклы обладают противоопухолевыми свойствами.
Обзор литературы позволяет прогнозировать высокую противоопухолевую активность соединений, содержащих гидроксильные, метоксильные, метоксикарбонильные и циано-группы. Для их синтеза мы использовали тетрацианоэтилен, малононитрил, метил 2,4-диоксобутаноаты, альдегиды.
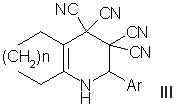
Метил-6-амино-3-ацил-4-арил-5-циано-4Н-пиран-2-карбоксилаты I получены реакциями 2-арилиденмалононитрилов с метил 2,4-диоксобутаноатами. Синтез 9-арил-12-имино-10,11-диоксатрицикло [5.3.2.01,6]додекан-7,8,8-трикарбонитрилов IIосуществлен из тетрацианоэтилированного аддукта циклогексанона и альдегидов по известной методике. Реакциями тетрацианоэтилированных аддуктов циклогексанона и циклогептанона с гидробензамидами получены 1,2-дигидропиридин-3,3,4,4-тетракарбонитрилы III.
2,5-Бис-(3,4,5-триметоксифенил)пирролидин-3,3,4,4-тетракарбонитрил IVполучен путем взаимодействия 1,1,2,2-тетрацианоэтана с N,N′-бис(4-метоксибензилиден)-1-(4-метоксифенил)метандиамином.



I: Ar = 3,4,5-(MeO)3C6H2 (a, b, c), 4-MeOOCC6H4 (d), 2-F-6-ClC6H3 (e); R = Me (a), 2-Fu (b), 3,4-(MeO)2C6H3 (c), 4-BrC6H4 (d), 3,4-(MeO)2C6H3 (e).
II: Ar = 3,4,5-(MeO)3C6H2 (a), 3-MeO-4-HOC6H3 (b), 4-MeOOCC6H4 (c), 4-(CH3)2NC6H4 (d).
III: n = 2 (a, b), 3 (c); Ar = 4-MeOC6H4 (a), 2-Thienyl (b, c).
Антипролиферативная активность цианозамещенных соединений I-IVисследована в Национальном институте рака (США). Для исследований использовали модель invitro, позволяющую стандартизовать условия эксперимента для повторяющихся серий. Исследования проведены на 60 клеточных линиях, полученных из опухолей легких, толстой кишки, мозга, яичников, почек, предстательной железы, молочной железы, а также лейкемии и меланомы человека. Обнаружено, что из исследованных на противоопухолевую активность веществ 2-(4-метоксифенил)-1,2,5,6,7,8-тетрагидрохинолин-3,3,4,4-тетракарбонитрилы IIIа,b является наиболее перспективным для дальнейших исследований (таблица 1). При концентрации 10–5 М это соединение оказывает значительное ингибирование роста опухолевых клеток. Получены следующие результаты:
Таблица 1
Результаты исследования антипролиферативной активности соединений при концентрации 10–5M*
|
Соединение |
Культура клеток / ингибирование,% |
||||||||
|
лейкоза |
рака легких |
рака толстой кишки |
рака мозга |
Меланомы |
рака яичников |
рака почек |
рака простаты |
рака молочной железы |
|
|
Ia |
- |
NCI-H522/ 14.19 |
- |
SNB-75/ 14.9 |
SK-MEL-2/ 11.36 |
- |
- |
- |
- |
|
Ib |
- |
- |
- |
SNB-75/ 19.3 |
- |
- |
CAKI-1/ 13.0 UO-31/ 11.3 |
- |
- |
|
Ic |
- |
A549/ATCC/ 12.65 HOP-92/ 11.8 NCI-H522/ 19.07 |
- |
- |
- |
- |
UO-31/ 11.2 |
- |
- |
|
Id |
- |
A549/ATCC/ 14.74 NCI-H522/ 17.93 |
- |
- |
UACC-257/ 12.06 |
- |
TK-10/ 15.9 UO-31/ 14.4 |
- |
- |
|
Ie |
- |
NCI-H23/ 12.23 NCI-H522/ 16.33 |
- |
SNB-75/ 11.0 |
- |
- |
A49/ 14.4 |
- |
- |
|
IIa |
SR/ 37.09 |
NCI-226/ 13.24 |
- |
SNB-75/ 18.6 |
UACC-62/ 15.50 |
- |
UO-31/ 14.8 |
- |
MDA-MB-231/ATCC/ 11.24 MDA-MB-468/ 22.50 |
|
IIb |
SR/ 25.02 |
NCI-H226/ 13.54 NCI-H522 / 12.05 |
- |
SNB-75/ 11.3 |
- |
- |
UO-31/ 18.3 |
- |
MDA-MB-468/ 18.21 |
|
IIc |
SR/ 13.45 |
NCI-H522/ 13.91 |
- |
- |
LOX IMVI/ 13.74 UACC-257/ 11.36 UACC-62/ 12.21 |
- |
- |
- |
MCF7/ 15.43 MDA-MB-468/ 15.38 |
|
IId |
SR/ 13.12 |
A549/ATCC/ 10.02 NCI-H522/ 13.76 |
- |
- |
UACC-257/ 17.73 |
- |
- |
- |
MCF7/ 10.93 |
|
IIIa |
CCRF-CEM/ 92.62 HL-60(TB)/ 58.67 K-562/ 87.50 MOLT-4/ 90.71 RPMI-8226 / 20.10 SR/ 98.88 |
EKVX/ 11.77 NCI-H522 / 76.19 |
COLO 205/ 88.21 HCT-116/ 21.25 HCT-15/ 34.07 HT29 / 20.07 SW-620/ 51.84 |
SNB-19/ 11.5 SNB-75/ 11.4 |
MALME-3M / 28.35 UACC-62/ 24.58 |
OVCAR-3/ 57.04 |
786–0/ 11.9 ACHN/ 62.87 CAKI-1/ 21.97 SN1C/ 11.30 TK-10 / 20.31 UO-31/ 24.25 |
- |
MCF7/ 50.13 MDA-MB-231/ ATCC/ 29.88 T47D / 50.80 MDA-MB-468 / 42.05 |
|
IIIb |
CCRF-CEM / 53.73 HL-60(TB) / 39.35 K-562 / 34.90 MOLT-4 / 54.37 SR/ 86.42 |
A549/ATCC / 11.53 EKVX / 11.70 NCI-H522 / 64.27 |
COLO 205 / 35.53 HCT-116 / 15.04 HCT-15 / 25.11 SW-620 / 48.60 |
- |
LOX IMVI / 12.54 UACC-257 / 15.26 UACC-62/ 12.12 |
OVCAR-3 / 40.54 |
ACHN / 62.25 CAKI-1/ 10.78 TK-10 / 15.32 UO-31 / 37.90 |
- |
MCF7/ 21.74 T47D/ 31.00 MDA-MB-468/ 17.79 |
|
IIIc |
- |
NCI-H522/ 10.63 |
HCT-116/ 11.45 |
SNB-75/ 44.6 |
- |
- |
UO-31 / 19.09 |
PC-3/ 10.58 |
MCF7 / 15.19 HS 578T/ 10.05 MDA-MB-468/ 19.84 |
|
IV |
HL-60(TB)/ 10.61 |
- |
- |
SNB-76/ 19.3 |
SK-MEL-5/ 10.47 |
- |
UO-31 / 16.25 |
- |
HS 578T/ 10.84 |
|
бусульфан |
- |
- |
- |
- |
M14/ 18.80 |
- |
- |
- |
- |
|
цисплатин |
- |
HOP-92/ 35.80 NCI-H522/ 28.40 |
- |
SNB-75/ 13.90 |
MALME-3M/ 15.80 SK-MEL-2/ 12.60 |
IGROV1/ 26.90 |
CAKI-1/ 17.40 UO-31 / 18.80 |
DU-145/ 19.90 |
BT-549 / 10.90 |
*указаны результаты при ингибировании роста >10 %
Результаты исследований показывают, что 2-R-1,2,5.6,7,8-тетрагидрохинолин-3,3,4,4-тетракарбонитрилы IIIa,b наиболее активены по отношению к лейкемии, они ингибирует рост всех известных клеточных линий. Таким образом, 2-(4-метоксифенил)-1,2,5.6,7,8-тетрагидрохинолин-3,3,4,4-тетракарбонитрил при концентрации 10–5М намного более активен по сравнению с известными противоопухолевыми препаратами, такими как бусульфан и цисплатин. Среднее значение ингибирования клеточных линий лейкемии составляет 59.31 %, а максимальное 98.88 %.
Полученные результаты подтверждают нашу гипотезу о том, что этил-1,1,2,2-тетракарбонитрильный фрагмент в циклических соединениях является фармакофором.
Работа выполнена при поддержке гранта РНФ № 15–13–10029.











