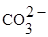Типичные макро- и спектроскопические особенности атеросклеротических поражений в аорте с использованием метода ИК-Фурье спектроскопии
Авторы: Агейкин Алексей Викторович, Темников Виктор Александрович, Пронин Игорь Александрович, Аверин Игорь Александрович
Рубрика: 6. Клиническая медицина
Опубликовано в
Дата публикации: 02.12.2014
Статья просмотрена: 112 раз
Библиографическое описание:
Агейкин, А. В. Типичные макро- и спектроскопические особенности атеросклеротических поражений в аорте с использованием метода ИК-Фурье спектроскопии / А. В. Агейкин, В. А. Темников, И. А. Пронин, И. А. Аверин. — Текст : непосредственный // Новые задачи современной медицины : материалы III Междунар. науч. конф. (г. Санкт-Петербург, декабрь 2014 г.). — Санкт-Петербург : Заневская площадь, 2014. — С. 30-34. — URL: https://moluch.ru/conf/med/archive/153/6790/ (дата обращения: 24.04.2025).
До середины XX века возраст считался основным определяющим фактором развития атеросклеротического процесса. Об избытке холестерина в атеросклеротических поражениях у человека было хорошо известно ещё в начале века, когда Н. Н. Аничков в 1913 г. создал экспериментальную модель атеросклероза на животных, скармливая холестерин кроликам.
Атеросклероз до сих пор является патологическим состоянием, лежащим в основе множества различных расстройств, включая цереброваскулярные заболевания и заболевания аорты, коронарную болезнь сердца, а также заболевания системы периферического артериального кровообращения [1].
На сегодняшний день ведущие мировые ученые в процессе изучения атеросклеротического процесса всё большее предпочтение отдают изучению механизмов функционирования эндотелия и интимы, как внутренней оболочки сосуда.
Известно, что вся система кровообращения выстлана сплошной оболочкой, толщиной в одну клетку, — сосудистым эндотелием. В норме сосудистый эндотелий представляет собой «емкость» для крови и образует границу между циркулирующими компонентами крови и всеми остальными тканями организма. Он имеет стратегическое местоположение, удобное для мониторинга системных и локально появляющихся стимулов и изменения своего функционального состояния.
В аорте и её главных ветвях, а именно, коронарных артериях, эндотелий вместе с небольшим количеством внеклеточного матрикса (армированного композита коллагена и эластических волокон, заключенного в вязкоэластический гель) образует нормальную внутреннюю оболочку (tunicaintima). Кроме того, этот внутренний концентрический слой артериальной стенки представляет собой первичный локус атеросклеротического процесса.
Более столетия назад патологоанатомы приступили к составлению каталога макро- и микроскопических изменений, вовлекающих интиму, которые отражают прогрессирование от появления ранних жировых отложений до образования важных в клиническом отношении бляшек [2].
Интима коронарных артерий человека имеет как утолщенные, так и более тонкие участки. Различия в толщине наблюдаются у каждого человека с детства; они могут появиться в период внутриутробного развития и являются следствием физиологических вариаций сил сдвига и натяжения, действующих вдоль артерий. Более толстые участки интимы обнаруживаются в местах разветвления артерий или вблизи от них и называются адаптивными утолщениями интимы. Такие утолщения самоограничиваются в росте и не приводят к закупорке коронарного сосуда уже в зрелом возрасте. Подобные изменения также наблюдаются и в сосудистой стенке аорты, которые визуализируются как чередование мест с утолщенной интимой.
После смерти, вследствие сосудистого коллапса и сокращения, толщина интимы, особенно в отдельных участках, становится настолько выраженной, что адаптивные утолщения могут выбухать в просвет артерий, о чем говорит отсутствие растяжения артерий до прижизненных размеров, к примеру, при приготовлении гистологических препаратов [3]. Кроме того, потеря эластичности, как правило, связана с прогрессированием атеросклеротического процесса в виде липидной бляшки, трансформации её в фиброзную бляшку и с последующей кальцификацией отдельных участков сосудистой стенки.
Следовательно, по макроскопическим изменениям можно оценить степень поражения и стадию развития атеросклеротического процесса. Для подтверждения данного заключения нами был применен метод неразрушающего контроля ИК-Фурье спектроскопия, используемый для оценки компонентного состава.
В качестве объекта для исследования выбраны участки нативных препаратов брюшной части аорты человека размером (1×1) см2. Забор материала осуществлялся у 20 трупов мужского пола в возрасте 40–65 лет. Процесс развития атеросклероза в образцах при макроскопическом исследовании соответствовал 2 степени (выраженной — площадь поражения 25 %−50 %) и находился на II стадии (липидные пятна, фиброзные бляшки и «осложненные поражения»). Также забор материала осуществлялся у 20 трупов в возрасте 23–26 лет, брюшная часть аорты которых при макроскопическом исследовании не была поражена атеросклерозом.
После взятия материала для исследования осуществлялось его погружение в изотонический (0,9 %) раствор натрия хлорида с последующим получением срезов сосудистой стенки, толщиной 40 мкм, с помощью замораживающего микротома МЗ-2. Материал помещался на замораживающий столик микротома, после чего производилась заморозка исследуемой ткани до T = –10° С и получение срезов размером (1×1) см2.
Затем выполнялось погружение образцов тканей в кюветы с дистиллированной водой, после чего производилась фиксация образцов на алюминиевой фольге, толщиной 14 мкм, путем наложения полученных срезов на её глянцевую сторону.
На заключительном этапе подготовки материала к исследованию осуществлялась сушка готовых образцов в течение 15 минут при температуре 37º С в электрическом суховоздушном термостате АТ-2.
Исследование полученных образцов производилось с использованием ИК-Фурье спектрометра ФСМ 1201 (ООО «Инфраспек», г. Санкт-Петербург, Россия) в режиме отражения. С помощью программы ASpec 1.1 выполнялась предварительная подготовка спектрометра для исследования. На заключительном этапе обработки спектров производилось вычитание спектров поглощения воды, после чего осуществлялся анализ полученных результатов.
На рисунке 1а и 1б представлены макроскопический препарат и ИК-спектр пропускания tunicaintima брюшной части аорты человека, препарат которой был подготовлен по вышеизложенной методике.
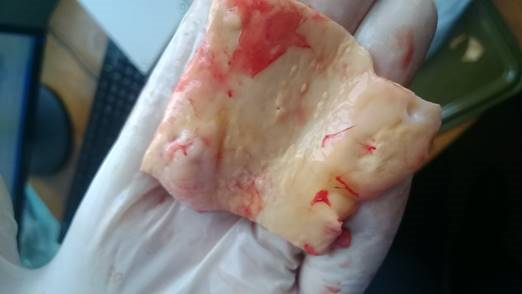
Рис. 1а. Макропрепарат брюшной части аорты, пораженной атеросклерозом (мужчина, 55 лет).
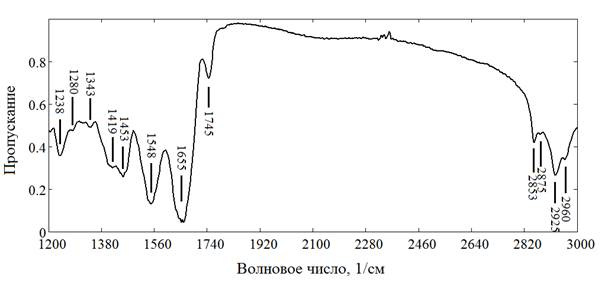
Рис. 1б. ИК-спектр пропускания tunicaintimaбрюшной части аорты, пораженной атеросклерозом (мужчина, 55 лет)
Подробная идентификация полос поглощения приведена в таблице 1. Большинство интенсивных полос могут быть отнесены к функциональным группам белков, холестерола, а также сложных эфиров холестерола.
Таблица 1
Полосы пропускания ИК — спектра tunicaintimaбрюшной части аорты человека, пораженной атеросклерозом.
|
Волновое число, см−1 |
Типы колебаний |
Основные соединения |
|
2960 |
νaCH3 |
жиры |
|
2925 |
νaCH2 |
жиры |
|
2875 |
νsCH3 |
жиры |
|
2853 |
νaCH2 |
жиры |
|
1745 |
νC=O |
сложные эфиры холестерола |
|
1655 |
Амид I (νC=O) |
белки (коллаген, эластин) |
|
1548 |
Амид II (νCN + δNH) |
белки (коллаген, эластин) |
|
1453 |
δaCH3 |
жиры |
|
1419 |
|
карбонат-ион |
|
1343 |
δCH3 |
белки (коллаген, эластин) |
|
1280 |
ρCH2 |
жиры |
|
1238 |
Амид III (νCNH) |
белки (коллаген, эластин) |
* условные обозначения колебаний: ν — валентные; δ — деформационные; s — симметричные; a — асимметричные; ρ — маятниковые
Полосы поглощения, соответствующие частотам 1655, 1548, 1238 см−1, относятся к амидным I, II и III колебаниям. Частота 1655 см−1 соответствует валентным C=O колебаниям (νС=О, амид I), частота 1548 см−1 — валентным CN и деформационным NH колебаниям (νCN + δNH, амид II), а частота 1238 см−1 — валентным CNH колебаниям (νCNH, амид III). Полосы поглощения 1453−1 и 1343−1 относятся, вероятно, к деформационным симметричным и асимметричным колебаниям CH в молекулах белков. Таким образом, все эти группы полос поглощения относятся, по всей видимости, к коллагену и эластину, из которых, как известно, нормальная интима состоит на 50 % сухого веса.
Макроскопические данные, полученные при визуальном осмотре, соответствуют 2 степени II стадии развития атеросклеротического процесса, что подтверждается и при спектроскопическом исследовании интимы брюшной части аорты. Следовательно, ИК-Фурье спектроскопия может выступать в качестве альтернативы микроскопическому анализу.
Отсутствие атеросклеротических изменений на макроскопическом препарате (рисунок 2а) здоровой брюшной части аорты подтверждается спектром пропускания её tunicaintima, где не наблюдается других значительных полос поглощения (рисунок 2б),
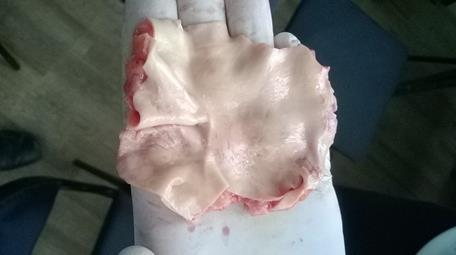
Рис. 2а. Макропрепарат здоровой брюшной части аорты,(мужчина, 25 лет)
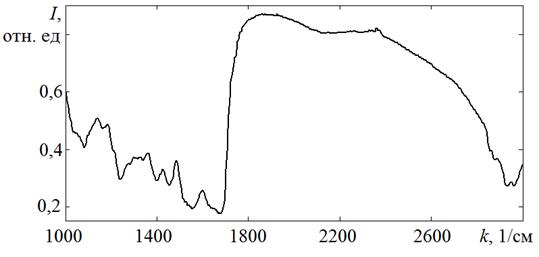
Рис. 2б. Спектр пропускания tunica intima брюшной части аорты, не пораженной атеросклерозом (мужчина, 25 лет)
В исследуемом образце интимы также имеются полосы поглощения на частотах 1745 и 1157 см−1, что специфично для сложных эфиров холестерина (например, олеата холестерина). Частота поглощения 1745 см−1 соответствует валентным колебаниям связи C=O (νС=О), частота 1157 см−1 — валентным колебаниям CO сложных эфиров (νСО).
Как уже видно из рисунка 1б, имеется значительная разница в концентрации органических компонентов. Особенный интерес представляет полоса поглощения на частоте 1745 см−1, характеризующая насыщение интимы аорты сложными эфирами холестерола.
Кроме того, степень насыщения сложными эфирами холестерола по частоте 1745 см−1 можно оценить при сравнении спектров пропускания tunica intima брюшной части аорты у лиц различных возрастных групп (40 лет и 65 лет), представленные на рисунке 3. Данный пик на этой частоте, снятого с tunica intima брюшной части аорты мужчины 65 лет, более выраженный, что свидетельствует о присутствии во внутренней стенке сосуда большего количества сложных эфиров холестерола, по сравнению со спектром, полученного при исследовании трупного материала аорты у 40-летнего мужчины.
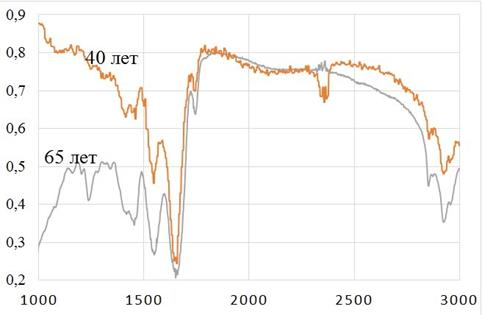
Рис. 3. Спектр пропускания tunica intima брюшной части аорты (мужчины, 40 лет и 65 лет)
Таким образом, ИК-Фурье спектроскопия позволяет быстро и качественно оценить степень поражения атеросклерозом сосудов человека по разработанной и описанной нами в статье методике, как показано на примере брюшной части аорты. Кроме того, для оценки компонентного состава ИК-Фурье спектроскопия может выступать в качестве альтернативы существующему микроскопическому методу исследования. Вышеуказанные достоинства ИК-Фурье спектроскопии выводят данный метод на тот уровень, который в дальнейшем предоставит возможность проводить экспресс — диагностику различных патологий.
Литература:
1. Агейкин А. В. Сравнительный анализ атеросклеротического поражения бедренной и плечевой артерий с помощью метода ИК-Фурье спектроскопии // Актуальные проблемы гуманитарных и естественных наук. 2014. № 9. С. 344–346.
2. Ross R. The pathogenesis of atherosclerosis a perspective for the 1990´s // Nature 1993; 362:801–809.
3. Stary HC. Macrophages, macrophage foam cells, and eccentric intimal thickening in the coronary arteries of young children // Atherosclerosis 1987; 64:91–108.
4. P. Moreno, R. A. Lodder, W. O'Connor and J. E. Muller, Method and apparatus for in vivo identification and characterization of vulnerable atherosclerotic plaques // US Pat., # 6,816,743, Nov. 9, 2004.
5. Kodaly, D.R., D. M. Small, J. Powell, K. Krishnan (1991) Infrared micro-imaging of atherosclerotic arteries // Appl Spectrosc 45: 1310–1317.
6. Stamou, S.C., S. W. Boyce, H. C. Cooke, B. D. Carlos, L. C. Sweet, P. J. Corso (2002) One-year outcome after combined coronary artery bypass grafting and transmyocardial laser revascularization for refractory angina pectoris // Am J Cardiol 89: 1365–1368.
7. R. Manoharan, J. J. Baraga, R. P. Rava, R. R. Dasari, M. Fitzmaurice, M. S. Feld Biochemical analysis and mapping of atherosclerotic human artery using FT-IR microspectroscopy // Atherosclerosis 103 (1993) 181–193.