Особенности диагностики и клинико-рентгенологические проявления легочных микобактериозов
Авторы: Кузюта Илья Леонидович, Кривонос Павел Степанович
Рубрика: 6. Клиническая медицина
Опубликовано в
III международная научная конференция «Медицина: вызовы сегодняшнего дня» (Москва, январь 2016)
Дата публикации: 07.01.2016
Статья просмотрена: 3478 раз
Библиографическое описание:
Кузюта, И. Л. Особенности диагностики и клинико-рентгенологические проявления легочных микобактериозов / И. Л. Кузюта, П. С. Кривонос. — Текст : непосредственный // Медицина: вызовы сегодняшнего дня : материалы III Междунар. науч. конф. (г. Москва, январь 2016 г.). — Москва : Буки-Веди, 2016. — С. 34-39. — URL: https://moluch.ru/conf/med/archive/193/9413/ (дата обращения: 24.04.2025).
Микобактериоз легких (МЛ) — это инфекционное заболевание легких, вызываемое нетуберкулезными микобактериями (НТМБ). Первые сообщения о так называемых атипичных микобактериях, впоследствии названных нетуберкулезными, появились в 30-е годы XX века [2]. Роль НТМБ, как этиологического фактора в различной патологии, долгое время не обсуждалась, поскольку их рассматривали как микробы окружающей среды, колонизирующие организм человека. НТМБ широко распространены в природе, являются обычными обитателями экологических резервуаров, воды, почвы, однако некоторые из них, при определенных условиях, могут вызывать заболевание у людей — микобактериозы [1]. Многие виды НТМБ обладают высокой природной устойчивостью к действию различных дезинфектантов, многих химиопрепаратов, в том числе с противотуберкулезной активностью и способны выжить в экстремальных для них условий путем синтеза защитной пленки [7]. В настоящее время описано более 140 видов НТМБ, 40 из которых могут явиться этиологическими агентами заболеваний легких [5]. Отличительными особенностями микобактериозов, в том числе и при поражении легких, является то, что они не передаются от заболевшего человека другим людям и для их развития необходимы предрасполагающие факторы. Такими факторами являются массивный контакт с природными источниками НТМБ и предрасположенность организма человека к инфекции, в частности наличие иммуносупрессии [4]. Клиническое распознавание МЛ связано с трудностью видовой идентификации НТМБ, схожестью клинико-рентгенологических и морфологических проявлений болезни. У части пациентов МЛ трактуется как туберкулез с множественной лекарственной устойчивостью, а у других -диагностируются хронические неспецифические заболевания легких [1]. В обоих случаях пациенты не получают адекватное лечение.
В последнее десятилетие во многих странах, в том числе и в нашей республике, на фоне снижения заболеваемости туберкулезом отмечается значительный рост МЛ, что обусловлено нарастанием случаев ВИЧ-инфекции и других иммунодефицитных состояний, а также совершенствованием методов лабораторной диагностики НТМБ. В республике внедрена в практику современная лабораторная технология выделения и видовой идентификации НТМБ с применением информативных молекулярно-генетических методов исследования [3]. Однако многие вопросы диагностики, тактики лечения и диспансерного наблюдения при МЛ остаются не решенными и требуют дальнейшего изучения.
Цель работы — изучение клинико-рентгенологических и лабораторных проявлений легочных микобактериозов, возможности их ранней диагностики и эффективность проведенного лечения у пациентов, находившихся на стационарном обследовании и лечении в «РНПЦ пульмонологии и фтизиатрии», а также в УЗ «Противотуберкулёзный диспансер № 2 г.Минска» с 1 января 2012 года по 31 декабря 2012 года, и, с 1 января 2014 года по 31 декабря 2014 года.
Задачи:
- Оценить видовой спектр нетуберкулёзных микобактерий в исследуемой группе.
- Оценить факторы риска развития лёгочного микобактериоза у пациентов.
- Проанализировать результаты физикального, лабораторных, и клинико — рентгенологических обследований пациентов, которым был выставлен диагноз «Микобактериоз лёгких».
- Оценить эффективность стационарного и амбулаторного лечения пациентов.
Материалы и методы исследования
Проводился ретроспективный анализ историй болезни 36 пациентов, находившихся на стационарном обследовании и лечении в УЗ «Республиканский научно-практический центр пульмонологии и фтизиатрии» и УЗ «Противотуберкулезном диспансере № 2 г. Минска» в период с 1 января по 31 декабря 2012 года (22 пациента) и с 1 января по 31 декабря 2014 года (14 пациентов). Отбор пациентов в исследуемую группу проводился в соответствии с рекомендациями Американского торакального общества и Американского общества по инфекционным болезням [6]. Клинические критерии включали: наличие симптомов заболевания лёгких, очаговых/полостных изменений на рентгенограмме, или на КТ высокого разрешения — мультифокальных бронхоэктазов в сочетании со множественными мелкими очагами. Микробиологическими критериями являлись: обнаружение 2 положительных результатов посева мокроты на НТМБ из разных проб или более, или по меньшей мере 1 положительный посев на НТМБ бронхоальвеолярного лаважа (БАЛЖ) или промывных вод бронхов, или гистопатологические изменения в трансбронхиальном или ином биоптате легкого при положительном посеве на НТМБ, или по меньшей мере 1 положительный посев мокроты, или посев БАЛЖ или промывных вод бронхов на НТМБ.
Для выделения и идентификации НТМБ использовался алгоритм, включающий изучение морфологии колоний, пигментообразования, культивирование материала на питательных средах, идентификацию выделенных микобактерий с помощью микробиологических и молекулярно-генетических методов [6]. Выделение микобактерий проводили микробиологическими методами на плотной питательной среде Левенштейна-Йенсена и жидкой среде Миддлбрук 7Н9 в автоматизированной системе Bactec MGIT 960 (Becton Dickinson, США). Для идентификации НТМ использовали молекулярно-генетический метод GenoTypeMycobacteriumCM (HainLifeScience, Германия) [3]. Лекарственную чувствительность НТМБ изучали методом абсолютных концентраций на плотной питательной среде Левенштейна-Йенсена с использованием критических концентраций, установленных для М. tuberculosis.
Анализировались видовая принадлежность НТМБ, возрастно-половой состав пациентов, предъявляемые жалобы, результаты физикальных, лабораторных, инструментальных, рентгенологических методов обследований; наличие сопутствующей легочной патологии, а также факторов, индуцирующих иммуносупрессию; результаты стационарного и амбулаторного лечения.
Анализ полученных данных
Микробный спектр в исследуемой группе представлен на рисунке 1. Среди медленнорастущих НТМБ чаще определялись M.avium (16 чел.- 44,4 %), а в единичных случаях выявлялись M.intracellulare (4 чел.-11,1 %), M.kansasii (1 чел-2,8 %) и сочетание Micobacteriumavium с M. intracellulare (1 чел-2,8 %). Быстрорастущие НТМБ были представлены M.fortuitum (11 чел. — 30,5 %), M.scrofulaceum, M.abscessus и M.gordonae выявлялись по одному случаю (2,8 %)
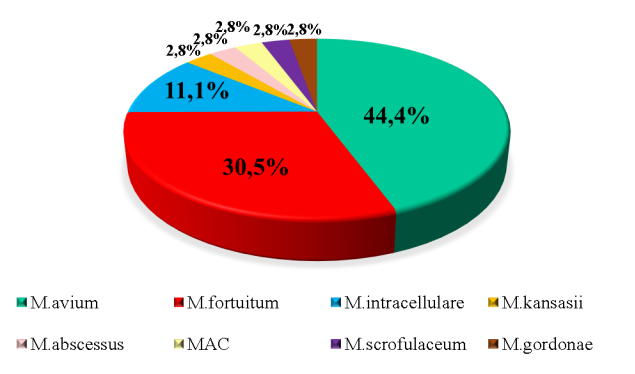
Рис. 1. Видовая принадлежность НТМБ
В изучаемой группе насчитывалось 22 женщины и 14 мужчин, в возрасте от 28 до 83 лет, 56,3 % из них составляли лица старше 50 лет. Средний возраст составил 54,58 года. Заболевания, вызванные M.аvium, чаще встречались у женщин 60 лет и старше (50 %), а заболевания, вызванные М.fortuitum — преимущественно у мужчин трудоспособного возраста (45,5 %) (таблица 1).
Таблица 1
Половозрастная структура пациентов с МЛ.
|
Пол / возраст |
M.avium |
M.fortuitum |
M.intracellulare |
M.kansasii |
M.abscessus |
M. avium complex (MAC) |
M.scrofulaceum |
M.gordonae |
|
Муж. |
6 |
6 |
1 |
0 |
1 |
0 |
0 |
0 |
|
Жен. |
10 |
5 |
3 |
1 |
0 |
1 |
1 |
1 |
|
20–29 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
30–39 |
1 |
3 |
0 |
0 |
1 |
0 |
0 |
0 |
|
40–49 |
2 |
2 |
1 |
1 |
0 |
0 |
0 |
0 |
|
50–59 |
4 |
4 |
1 |
0 |
0 |
0 |
0 |
1 |
|
60 и старше |
8 |
2 |
2 |
0 |
0 |
1 |
1 |
0 |
|
Всего |
16 |
11 |
4 |
1 |
1 |
1 |
1 |
1 |
У 6 пациентов (16,7 %) были обнаружены НТМБ в сочетании с микобактериями туберкулеза (МБТ). Среди всех обследованных пациентов выявлено 2 случая (5,6 %) клинически значимой иммуносупрессии, связанной с ВИЧ-инфекцией. У 5 пациентов (13,89 %) МЛ протекал на фоне хронических неспецифических заболеваний легких, а у 6 пациентов сочетался с активным туберкулезом.
У 2-х чел. (5,6 %) в анамнезе имелись пылевые профессиональные вредности с экспозицией более 5 лет. Не выявлено иммуносупрессия, связанной с длительным приемом системных глюкокортикостероидов, цитостатиков, ингибиторов фактора некроза опухолей-α.
Большинство пациентов предъявляли жалобы респираторного (26 чел., 72,2 %) и интоксикационного (21 чел., 58,3 %) характера. В 19,4 % (7 чел.) случаев отмечена боль в грудной клетке, в 11,1 % (4 чел.) — кровохарканье, в 5,6 % (2 чел.) — потеря массы тела. Однако у 5 пациентов (13,9 %) имелось бессимптомное начало болезни. В большинстве случаев постепенное начало заболевания (22 чел., 61,1 %) превалировало над острым (9 чел., 25 %) или бессимптомным (5 чел.,13,9 %) (рисунок 2).
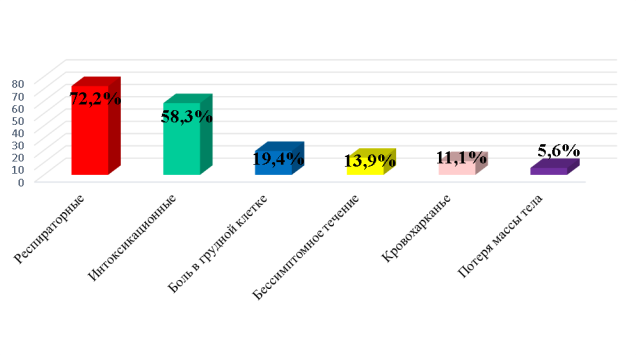
Рис. 2. Частота клинических проявлений МЛ
При аускультации обнаруживались следующие симптомы: у 10 пациентов (27,8 %) выслушивалось жёсткое дыхание, у 4 (11,1 %) — сухие хрипы, у 2,8 % (1 чел.) — влажные разнокалиберные хрипы; в 2,8 % (1 чел.) случаев отмечен коробочный звук при перкуссии.
В общем анализе крови в 41,7 % случаев (15 чел.) выявлена ускоренная СОЭ выше 30 мм/ч, и в 44,4 % (16 чел.) случаев — лейкоцитоз периферической крови (от 10,5*109/л) как универсальные маркеры воспаления, также в 8,3 % (3 чел.) отмечали палочкоядерный сдвиг влево.
Рентгенологические проявления МЛ оценивались по результатам комплексного рентгенологического обследования включая обзорные рентгенограммы, линейные томограммы и компьютерную томографию высокого разрешения. У 30 чел. (83,3 %) выявляли двустороннюю и одностороннюю, мелко- и среднеочаговую диссеминацию, у 23 чел. (63,9 %) — грубоячеистую деформацию легочного рисунка,у 22 чел. (61,1 %) — очагово-фокусные элементы, у 15 чел.(41,7 %) — полостные образования, у 8 чел.- (22,2 %) обнаруживали бронхоэктазы, у 7 чел. (19,4 %.) — уменьшение в размерах долей легких, у 3 чел. (8,3 %) — смещения корней легких, также у 3 (8,3 %) — уплотнение междолевой плевры, у 2 чел. (5,6 %) визуализировались гиперплазированные внутригрудные лимфатические узлы и у 1 (2,8 %) — участок гиповентиляции легкого (рис. 3). Выявлена определенная зависимость характера рентгенологических изменений от этиологического агента, вызвавшего заболевания. Так, при МЛ вызванных M.avium рентгенологические проявления носили разнообразный характер. Отличительная их особенность наличие мультифокальных бронхоэктазов (у 5 чел. из 16). При доказанной этиологии МЛ, вызванного M.fortuitum во всех случаях выявлялись одно- и двусторонние очагово-фокусные изменения с полостями деструкции (11 чел.). МЛ при M.intracellulare во всех случаях рентгенологически характеризовались деформацией легочного рисунка или более или менее распространённой очаговой диссеминацией в легочной ткани.
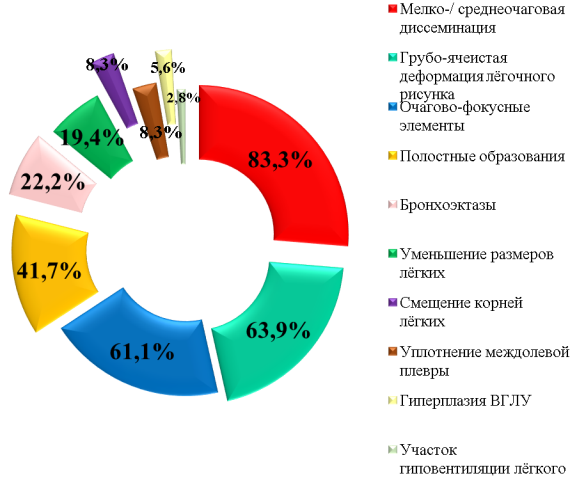
Рис. 3. Частота отдельных рентгенологических проявлений МЛ
По данным спирографии у 10 обследуемых (27,8 %) обнаруживали тахипноэ и обструктивные нарушения вентиляции легких, у 5 (13,9 %) — рестриктивные нарушения, а наиболее часто выявлялись нарушения вентиляции смешанного типа у 13 пациентов (36,1 %).
В настоящее время не разработаны критерии определения лекарственной чувствительности НТМБ. У 22 обследуемых на предмет резистентности штамма микобактерий к антибиотикам и противотуберкулезным лекарственным средствам выявлялась устойчивость НТМБ к изониазиду (22 чел., 100 %), рифампицину (18 чел., 81,8 %), стрептомицину (16 чел., 72,2 %), ПАСК (15 чел., 68,2 %). Чаще НТМБ сохраняли чувствительность к таким препаратам как: канамицин (8 чел., 36,64 %), кларитромицин (7 чел., 31,8 %), циклосерин (5 чел., 22,7 %), амикацин (5 чел., 22,7 %), этамбутол (3 чел., 13,6 %).
В настоящее время не разработаны унифицированные схемы лечения МЛ, поэтому рекомендуется применять эмпирические режимы лечения. Так при МЛ, вызванных M.avium схема лечения предусматривает назначение кларитромицина в сочетании с амикацином и этамбутолом. Химиотерапия МБ, вызванных быстрорастущими НТМБ наиболее индивидуализирована. Препаратами выбора являются амикацин, левофлоксацин, доксициклин, кларитромицин.
Эффективность лечения оценивалась по клиническим, рентгенологическим и лабораторным показателям. Так у 31чел. (86,1 %) отмечено прекращение жалоб, у 33 чел. (91,7 %) — бактериовыделения. У 83,3 % отмечено улучшение рентгенологической картины: рассасывание очагов и полостных образований, исчезновение грубоячеистой деформации легочного рисунка. У 3 чел. (8,3 %), при сочетании с туберкулезом наступил смертельный исход от прогрессирующего специфического процесса, МБ во всех случаях являлся сопутствующей патологией.
Отдалённые результаты лечения анализировались у пациентов, проходивших стационарное обследование и лечение в 2012 году. Исследуемую группу составили 20 человек. Лечение пациентов закончено преимущественно в конце 2013 г. 3 пациента (15 %) не получали лечения после выписки из стационара по собственному желанию. У 1 пациента наблюдалось сохранение клинико-рентгенологической картины МЛ, подтвержденного бактериологическим методом. Рентгенологически определялись остаточные поствоспалительные изменения у 5 пациентов (25 %), у 2 человек не определялось рентгенологических изменений, у 1 (4,76 %) — частичное рассасывание изменений. У 3 чел. (15 %) выявлялись бронхоэктазы, у 1 (5 %) — сохранялась диссеминация, у 1 (5 %) — цирроз лёгких с полостями. После химиотерапии МЛ у 5 пациентов (25 %) был установлен диагноз туберкулёза с выделением микобактерий туберкулеза.
Заключение
Микобактериоз легких чаще встречаются у людей обоего пола, преимущественно пожилого возраста, имеющих хронические легочные процессы воспалительной природы, и у пациентов без клинически значимой иммуносупрессии. Проявления МЛ не имеют специфических признаков, складываются из проявлений воспалительного процесса и симптомов поражения респираторного тракта. МЛ протекают по типу туберкулёза со схожими рентгенологическими проявлениями или неспецифических заболеваний легких, что затрудняет своевременное распознавание заболевания. Выявление НТМБ, их идентификация, при наличии клинических и рентгенологических проявлений являются основными диагностическими критериями МЛ. Значительный полиморфизм проявлений легочных МБ требует своевременной диагностики и лечения, а также разработки единых, стандартизированных протоколов диагностики и химиотерапии заболевания. Лечение МБ, особенно на амбулаторном этапе недостаточно эффективно и требует совершенствования организационных форм его проведения. Необходимо объединение усилий фтизиатров, пульмонологов и терапевтов по выявлению пациентов с возможным МЛ и проведения им необходимых для подтверждения диагноза методов обследования и адекватной терапии.
Литература:
- Акулов В. В., Кривонос П. С., Авдеева И. А., Залуцкая О.М, Новская Г. К. Особенности диагностики и клинико-рентгенологические проявления легочных миобактериозов //ARSMedica, 2013, № 3, С.4–6.
- Гунтупова Л. Д., Борисов С. Е., Гармаш Ю. Ю., Матвеева М. В.. Заболевания легких, вызванные нетуберкулезными микобактериями: клинико-рентгенологические критерии диагностики //Туберкулез и болезни легких — 2012. — № 10. — С.15–22.
- Литвинов В. И., Дорожкова И. Р. Выделение и идентификация нетуберкулёзных микобактерий/ В. И. Литвинов, И. Р. Дорожкова // Вестник РАМН. — 2010. — № 3. — С. 7–11.
- Суркова Л. К., Залуцкая О. М., Скрягина Е. М., Мультирезистентный Николенко Е. Н., Собещук О. П. Особенности диагностики микобактериозов легких // Мультирезистентный туберкулез: Клинико-эпидемиологические особенности и тактика лечения. Материалы международной научно-практической конференции «Внедрение новых подходов в борьбе с М/ШЛУ-ТБ в Беларуси», (г. Минск, 13–14 ноября 2014 года), Минск,2014, С.178–181.
- Daley C. L., Griffith D. E. Pulmonary non-tuberculous mycobacterial infections // Int. J. Tuberc. Lung Dis. — 2010. — Vol. 14, № 6. — Р.665–671.
- Griffith D. E., Aksamit T., Brown-Elliott B. A. et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. // Am J Respir Crit Care Med. 2007. -Vol. 175. -P.367–416.
- Primm T. P., Lucero C., Falkinham J. O... Impact on health of environmental mycobacteria // Clin Microbiol Rev. — 2004. -Vol.17. -Р. 98–106.











