Влияние иммобилизационного стресса на активность и топографию энтеральных ферментов на фоне введения феназепама
Авторы: Абдувахабова Нилуфар Абдусаид кизи, Аскарьянц Вера Петровна
Рубрика: 3. Медико-биологические дисциплины
Опубликовано в
IV международная научная конференция «Медицина и здравоохранение» (Казань, май 2016)
Дата публикации: 25.02.2016
Статья просмотрена: 220 раз
Библиографическое описание:
Абдувахабова, Н. А. Влияние иммобилизационного стресса на активность и топографию энтеральных ферментов на фоне введения феназепама / Н. А. Абдувахабова, В. П. Аскарьянц. — Текст : непосредственный // Медицина и здравоохранение : материалы IV Междунар. науч. конф. (г. Казань, май 2016 г.). — Казань : Бук, 2016. — С. 9-11. — URL: https://moluch.ru/conf/med/archive/194/9799/ (дата обращения: 03.04.2025).
В стрессорную реакцию организма почти всегда вовлекаются органы пищеварения. Агрессивность является важной формой зоосоциального поведения у животных разных видов, имеющая приспособительное значение и проявляющаяся видоспецифическим набором поведенческих реакций (2,4). Но особенности функционирования органов пищеварения в зависимости от поведенческих характеристик организма изучены недостаточно, ни в норме, ни при стрессе.
Актуальностью работы явилось выяснение функционального состояния тонкой кишки у крыс из агрессивной группы при иммобилизационном стрессе под влиянием транквилизатора феназепама.
Цель работы: изучения влияния феназепама на активность и топографию энтеральных ферментов у крыс из агрессивной группы в условиях иммобилизационного стресса.
Материалы иметоды: эксперименты проводились на взрослых беспородных крысах с массой тела 180–200 г. Использовались три группы крыс — смешанная (животные не проверялись на агрессивность), неагрессивная и агрессивная группы.
Животные проверялись на агрессивность по методике А. А. Рылова (1983); раздражителями являлись электрические импульсы, каждый из которых предъявлялся животным четырехкратно. Величина агрессивности, связанная с болью, оценивалась по показателю «средней болезненности схваток», возникающих в ответ на серию из 88 импульсов и количеству схваток из 88 возможных. Агрессивными крысами считаются те, у которых «средняя болезненность схваток» находится в пределах от 45,6 до 39,7. У крыс со средней агрессивностью этот показатель колеблется от 38,8 до 33,4. У неагрессивных особей он составляет 32,6–0.
Иммобилизационный стресс вызывали путем принудительной иммобилизации в течение 24 часов.
Феназепам вводили перорально с профилактической целью за 30 минут до стресса в дозе 2 мг/кг. В качестве контроля использовали крыс с соответствующей типологической характеристикой, которым перорально вводили эквивалентное количество дистиллированной воды. Массу тела и массу слизистой определяли обычным взвешиванием.
Активность пищеварительных ферментов определялась по следующим методикам: моноглицеридлипазы — методом А. М. Уголева и М. Ю. Черняховской(1969); глицил-1-лейцин — дипептидгидролаза — методом А. М. Уголева и Н. М. Тимофеевой (1969), амилазы — методом Смит-Роя в модификации А. М. Уголева (1969); сахаразы — методом Neleon в модификации А. М. Уголева и Н. Н. Иезуитовой (1969), лактазы — методом Dalhgvist (1968).
Активность ферментов рассчитывалась на 1 г массы сырой ткани слизистой оболочки тонкой кишки и выражалась в мг/мин/г для амилазы и в мкмоль/мин/г для остальных ферментов.
Статистическая обработка данных проводилась методом Стьюдента-Фишера.
Результат исследований: в этой серии опытов контролем служили показатели у интактных крыс из агрессивной группы.
В группе агрессивных крыс стресс привел к гибели 2-х особей из 10, подвергнутых иммобилизации, т. е. среди них летальность составляла 20 %.
Иммобилизация снижала массу тела у агрессивных крыс до 48-го часа включительно после стрессорного воздействия в 1,2 раза.
Масса слизистой оболочки уменьшалась через 6 ч и 24 ч после стресса вдоль всей тонкой кишки, особенно в двенадцатиперстной кишке и проксимальном отделе. Через 48 ч показатель нормализовался.
Активность большинства ферментов в гомогенате силизистой оболочки, снятой вдоль всей тонкой кишки, снижалась. Так, активность моноглицеридлипазы угнеталась в 1.7; в 1.8; в 2,3 раза через 6, 24, 48 ч соответственно.
Активность дипептид гидролазы уменьшалась в 1,8 раза и в 2,6 раза через 6 ч и 24 ч; нормализация произошла через 48 ч.
Амилолитическая активность ингибировалась на протяжении всего эксперимента в 1,6 раза, в 1,4 раза, в 2 раза (табл).
Таблица
Активность амилазы (мг/мин/г) вгомогенате слизистой оболочке, снятой вдоль всей тонкой кишке при иммобилизационном стрессе ипри стрессе на фоне феназепама укрыс из агрессивной группы. (М±m, n=6).
|
Условия эксперимента |
Время вчасах после стресса |
||
|
6 |
24 |
48 |
|
|
Интактные крысы (контроль) |
260,0±2,9 |
260,0±2,9 |
324,0±30,2 |
|
Иммобилизационный стресс |
165,0±9,5 p < 0,01 |
187,3±10,6 р < 0,05 |
158,3±5,4 р <0,001 |
|
Иммобилизационный стресс на фоне феназепама |
286,0±5,2 р >0,05 |
273,3±5,9 р >0,05 |
313,5±5,7 р >0,1 |
Сахаразная активность не изменялась через 6 ч после стресса и уменьшалась в 1,7 раза и в 1,5 раза через 24 ч и 48 ч после иммобилизации.
Лактазная активность не изменялась через 6 ч и 48 ч, но понижалась в 1,5 раза через 24 ч.
Распределение ферментативных активностей после стресса становилось равномерным вдоль всей кишки.
Активность моноглицеридлипазы снижалась в одинаковой степени во всех участках тонкой кишки через 6, 24, 48 ч, поэтому распределение ее оставалось таким же равномерным, как в контрольной группе.
Дипептидгидролазная активность снижалась через 6 ч и 24 ч в дистальном сегменте и не изменялась в остальных сегментах, вследствие чего ее распределение выровнялось на протяжении органа. Через 48 ч топография соответствовала контрольной, т.е вновь пик активности фермента сместился в дистальный сегмент, а в остальных отделах активность была ниже и, примерно, равна между собой.
Амилолитическая активность через 6, 24, 48 ч снижалась в двенадцатиперстной кишке и в проксимальном отделе и не изменялась относительно контроля в медиальном и дистальном сегментах, что способствовало выравниванию ее распределения на протяжении кишки.
Сахаразная активность через 6 ч после стресса не изменялась во всех сегментах, поэтому топография ее не отличалась от таковой в контроле — пик активности определялся в двенадцатиперстной кишке, далее активность снижалась в каудальном направлении. Через 24 ч и 48 ч после иммобилизации активность энзима ингибировалась в двенадцатиперстной кишке и проксимальном сегменте и не изменялась в 2-х каудальнее расположенных отделах, поэтому распределение ее стало равномерным (рис).
Активность лактазы через 6 ч и 48 ч после стресса не отличалась по величине от контрольной на всех участках кишки и топография ее была как в контроле, т.е наиболее высокая активность в двенадцатиперстной кишке, меньшая и примерно одинаковая между собой — в 3-х остальных сегментах. Через 24 ч после стресса активность лактазы ингибировалась а всех участках кишки, но больше — в двенадцатиперстной кишке, что привело к выравниванию ее распределения.
Профилактическое введение феназепама эффективно предупреждало развитие негативных последствий от иммобилизационного стресса у агрессивных крыс: во все сроки после стресса не менялись масса тела и масса слизистой, не наблюдалось изменение активности моноглицеридлипазы, дипептидгидролазы, амилазы (табл) и лактазы в гомогенате слизистой оболочки, снятой вдоль всей тонкой кишки. Только активность сахаразы повышалась в 1,8 раза через 24 ч.
Топография ферментативных активностей нарушалась без определенной системы через 6 ч, но уже через 24 ч для большинства ферментов топография соответствовала контролю (рис).
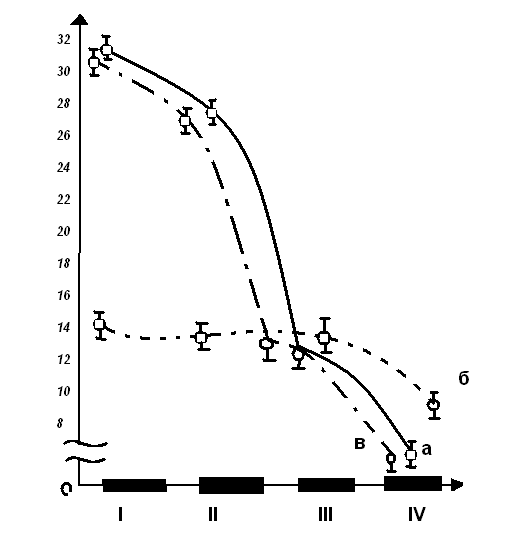
Рис. Распределение активности сахаразы вдоль тонкой кишки через 24 часа после стресса, а также после стресса на фоне феназепама. Ось абсцисс — отделы тонкой кишки (I-двенадцатиперстная, II-проксимальный, III-медиальный, IV-дистальный). Ось ординат — активность фермента в мкмоль/мин/г): а — интанктные крысы, б- иммобилизация, в — иммобилизация на фоне феназепама
Выводы:
У взрослых агрессивных крыс иммобилизация вызывает гибель 20 % особей, ингибирует активность всех ферментов, а распределение ферментативных активностей становится равномерным по длине тонкой кишки;
Общим для стресса всех взрослых крыс является снижение массы тела и массы слизистой оболочки;
Феназепам четко корректирует нарушения в морфо-функциональном состоянии тонкой кишки, что проявляется более быстрой нормализацией исследованных показателей.
Литература:
- Cox T; Stress, coping and problem solving// Work and stress.- 2001. — № 1.- P.5–14.
- Palmour R. M. Genetic models for study of aggressive behavior// Progr.neuropsychopharmasol and biol.psychiatr.- 2002.- V.7.-P.513–516.
- Уголев А. М. Физиология и патология пристеночного (контактного) пищеварения. С.-Пб. Наука, 2001.-230с
- Фурдуй Ф. И. современные представления о физиологических механизмах развития стресса.-Кишинев, 2001.-с.8–33.











