Показатели эхокардиографического исследования у пациентов с хронической обструктивной болезнью легких и кардиоваскулярной патологией
Авторы: Залаева Анастасия Борисовна, Шакиров Антон Альбертович
Рубрика: 3. Медико-биологические дисциплины
Опубликовано в
VII международная научная конференция «Медицина и здравоохранение» (Краснодар, январь 2019)
Дата публикации: 28.12.2018
Статья просмотрена: 960 раз
Библиографическое описание:
Залаева, А. Б. Показатели эхокардиографического исследования у пациентов с хронической обструктивной болезнью легких и кардиоваскулярной патологией / А. Б. Залаева, А. А. Шакиров. — Текст : непосредственный // Медицина и здравоохранение : материалы VII Междунар. науч. конф. (г. Краснодар, январь 2019 г.). — Краснодар : Новация, 2019. — С. 1-11. — URL: https://moluch.ru/conf/med/archive/318/14748/ (дата обращения: 24.04.2025).
Хроническая обструктивная болезнь легких (ХОБЛ) наряду с ишемической болезнью сердца, артериальной гипертензией (АГ) и сахарным диабетом более чем в 40 % случаев являются причиной смертельного исхода. ХОБЛ является одной из наиболее часто встречающихся патологий дыхательной системы среди взрослого населения. В последнее время уделяется внимание не столько особенностям клинических проявлений данного заболевания, сколько патогенетическим механизмам его развития в связи с установлением сопутствующих патологий на фоне ХОБЛ [1]. Полиморбидность является особенностью клиники внутренних болезней на сегодняшний день. Вопрос о коморбидности ХОБЛ и кардиоваскулярной патологии является актуальным в связи с развитием и прогрессированием одного заболевания на фоне другого и, как следствие, ограничением физической работоспособности вплоть до невозможности самообслуживания, инвалидизации и летального исхода. В основе коморбидности лежат единые патогенетические механизмы развития заболеваний. На фоне хронической обструктивной болезни легких наиболее часто развиваются такие патологии сердечно-сосудистой системы, как: артериальная гипертензия, ишемическая болезнь сердца, атеросклероз сосудов, в основе которых лежит стойкое повышение артериального давления. Медикаментозная терапия при сочетании данных патологий является актуальной задачей на сегодняшний день. Для ее решения необходимо выяснить основные патогенетические механизмы развития патологий и корреляционные связи между различными показателями функционального и морфологического состояния сердца и наличием, течением ХОБЛ [2,3,4,6]. Таким образом, целью нашего исследования явилась оценка морфологических и функциональных изменений сердца при сочетании ХОБЛ с АГ.
Материалы иметоды. Впериод с 2016 по 2017 год проведены эхокардиографические исследования 73 человек на базе пульмонологического отделения АГУЗ ПК Ордена «Знак Почёта» Пермской краевой клинической больницы № 1.
Были сформированы три группы — основная ХОБЛ с АГ (15 человек) и первая группа сравнения — ХОБЛ без АГ (12 человек). Вторую группу сравнения составили 21 человек с АГ, которая развилась не на фоне ХОБЛ. Группу контроля составили 25 практически здоровых лиц в отношении дыхательной и сердечно-сосудистой систем. Все группы были сопоставимы по полу и возрасту. Группа пациентов с ХОБЛ характеризуется преобладанием мужчин (83 %) над женщинами, как и группа пациентов с АГ (53 %) и сочетанной патологией (80 % мужчин). При этом пациенты основной группы и группы сравнения находились в одном возрастном коридоре и составили 62,5 ± 0,77 лет в среднем. Группа контроля представлена преимущественно мужчинами (58 %). Пациенты данной группы составили возрастную категорию 57,6 ± 2,48 лет.
Оценивали функциональное и морфологическое состояние сердца по следующим показателям эхокардиографии: размеры левого предсердия (парастернально и четырехкамерная (Ч-К)-позиция), конечный диастолический и систолический размеры левого желудочка (КДР и КСР), конечный диастолический и систолический объемы левого желудочка (КДО и КСО), ударный объем (УО), фракция выброса (ФВ), толщину межжелудочковой перегородки (МЖП), задней стенки левого желудочка (ЗСЛЖ), индекс массы миокарда левого желудочка (ИММЛЖ), относительная толщина стенки (ОТС), размеры правого предсердия (ПП) (длинная и короткая оси), размеры правого желудочка (ПЖ) (парастернально и Ч-К-позиция), толщина стенки, диаметр нижней полой вены (НПВ), % коллапса НПВ, диаметр аорты и раскрытие створок, диаметр легочной артерии (ЛА), систолическое и диастолическое давления в легочной артерии (СДЛА и ДДЛА), фиброзное кольцо, площадь, пиковый и средний градиенты, степень регургитации на аортальном, митральном, трикуспидальном и пульмональном клапанах.
Анализ полученных результатов проводили с помощью методов описательной статистики и программы Statistica 13 с учетом коэффициента Стьюдента и расчетом стандартной ошибки. Все полученные значения записаны в виде M+m (среднее арифметическое ± стандартная ошибка). Корреляционный анализ производился с учетом коэффициента ранговой корреляции Спирмена.
Результаты иобсуждение. У всех обследованных пациентов с ХОБЛ у 71 % выявлена АГ. При анализе морфологических и функциональных характеристик сердца и клапанного аппарата у пациентов с коморбидностью ХОБЛ и АГ были отмечены следующие изменения (табл.1).
Размеры левого предсердия увеличены: в парастернальной позиции 41,0 ± 1,49мм; в Ч-К позиции 51,0 ± 1,62мм и 41,0 ± 1,65 мм по длинной и короткой осям соответственно. При наличии у пациентов ХОБЛ без сопутствующей АГ размеры левого предсердия изменены не были. При АГ без ХОБЛ размеры левого предсердия были увеличены в меньшей степени (50,3 ± 0,92мм и 37,5 ± 0,92 мм в Ч-К позиции) в основном в длину.
При ХОБЛ в сочетании с АГ отмечаются функциональные изменения: незначительно сниженные показатели ударного объема (УО) 57,0±4,37мл при нормальных показателях фракция выброса (ФВ) 60,0 ± 2,02 %. При более длительном течении ХОБЛ и достижении тяжелой степени заболевания в фазе обострения на фоне недостаточного УО отмечается снижение и ФВ до 43 % и ниже. При этом снижение УО коррелирует с уменьшением конечного систолического объема (КСО) (r=0,726) (табл.2). КСО у группы пациентов ХОБЛ в сочетании с АГ соответствует 41,0 ± 5,76мл. Полученные результаты входят в пределы нормы, но нужно обратить внимание на дисперсию показателей КСО в сторону уменьшения вплоть до 18 мл у 73,3 %, а увеличение КСО обнаружено у 20 % обследованных до 84 мл (табл.1, рис.1).
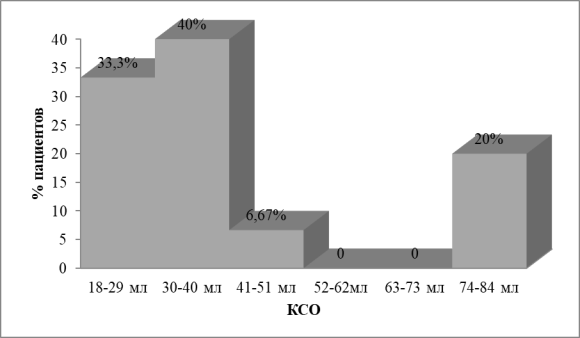
Рис. 1. Дисперсия показателей конечного систолического объема у пациентов с сочетанной патологией (мл)
Сохранение нормальных показателей фракции выброса можно объяснить стремлением сердца сохранить возможность функционирования за счет гипертрофии миокарда левого желудочка. Левое предсердие, как вспомогательный насос, препятствует увеличению давления в легочных венах и капиллярах во избежание застойных явлений в легких и поддерживает нормальное конечно-диастолическое давление в левом желудочке. Если же развивается какое-либо нарушение, связанное с проводимостью и автоматизмом (атрио-вентрикулярная блокада), то это может привести к летальному исходу [5].
Таблица 1
Показатели эхокардиографического исследования уздоровых, пациентов схронической обструктивной болезнью легких, артериальной гипертензией ипри сочетании этих заболеваний (M+m)
|
Показатели |
Здоровые n=25 |
ХОБЛ n=12 |
ГБ n=21 |
ХОБЛ+ГБ n=15 |
|
|
Размеры ЛП |
парастерн. |
33,2 ± 0,59 мм |
36,7 ± 0,33 мм |
37,5 ± 0,74 мм |
41,0 ± 1,49 мм |
|
Ч-К: длин.ось |
44,1 ± 0,78 мм |
46,3 ± 4,29 мм |
50,3 ± 0, 92 мм* |
51,0 ± 1,62 мм* |
|
|
Ч-К:кор.ось |
33,5 ± 0,81 мм |
33,5 ± 2,60 мм |
37,5 ± 0,92 мм* |
41,0 ± 1,65 мм * |
|
|
КСО |
28,0 ± 1,64 мл |
31,0 ± 1,87 мл |
33,2 ± 2,34 мл* |
41,0 ± 5,76 мл* |
|
|
УО |
57,2 ± 2,52 мл |
54,6 ± 5,87 мл |
63,6 ± 3,90 мм* |
56,0 ± 4,37 мл |
|
|
ФВ |
65,5 ± 1,03 % |
62,8 ± 1,89 % |
65,9 ± 1,27 % |
60,0 ± 2,02 %* |
|
|
МЖП |
9,8 ± 0,16 мм |
10,4 ± 0,40 мм |
12,8 ± 0,19 мм* |
13,0 ± 0,60 мм* |
|
|
ЗСЛЖ |
9,6 ± 0,16 мм |
10,2 ± 0,37 мм |
12,4 ± 0,20 мм* |
13,0 ± 0,52 мм* |
|
|
ИММЛЖ |
75,4 ± 3,88 г/м2 |
85,04 ± 6,8 мм |
119,2 ± 5,73 г/м2* |
146 ± 13,52 г/м2* |
|
|
Размеры ПП |
длин. ось |
43,6 ± 1,01 мм |
47,5 ± 4,27 мм |
48,9 ± 1,38 мм* |
52,0 ± 1,95 мм* |
|
корот. ось |
32,7 ± 1,71 мм |
36,8 ± 2,69 мм* |
36,6 ± 1,47 мм* |
40,0 ± 2,06 мм* |
|
|
Размеры ПЖ |
парстерн. |
25,3 ± 0,50 мм |
30,7 ± 1,86 мм* |
26,3 ± 0,63 мм |
30,0 ± 1,67 мм* |
|
Ч-К |
35,1 ± 1,01 мм |
39,3 ± 2,67 мм |
37,3 ± 2,1 мм |
43,0 ± 3,0 мм* |
|
|
толщина стенки |
4,7 ± 0,30 мм |
5,85 ± 1,15 мм |
5,0 ± 0,02 мм |
6,0 ± 0,52 мм* |
|
|
НПВ, диаметр |
17,2 ± 0,47 мм |
19,0 ± 2,0 мм |
18,7 ± 0,52 мм |
21,0 ± 1,04 мм* |
|
|
диаметр ЛА |
19,1 ± 0,60 мм |
21,8 ± 1,86 мм |
20,5 ± 0,52 мм |
26,0 ± 1,46 мм* |
|
|
СДЛА |
27,0 ± 1,91 мм.рт.ст. |
41,0 ± 4,04 мм.рт.ст* |
23 ± 5,23 мм.рт.ст. |
49 ± 7,21 мм.рт.ст. * |
|
Примечание: *- достоверность различий (р<0,05) со здоровыми
При анализе данных группы пациентов с ХОБЛ без сочетанной патологии сердечно-сосудистой системы выявлены незначительные отклонения от нормы в показателях КСО и УО, которые равны 31 ± 1,87мл и 54,6 ± 5,87мл соответственно. Индекс корреляции данных значений ниже, чем у группы пациентов с сочетанной патологией (r=0,542) (табл.2).
При анализе группы пациентов с артериальной гипертензией без ХОБЛ отмечены небольшие отклонения от нормы, которыми можно пренебречь в связи с их соответствием стандартной ошибке.
У пациентов с сочетанной патологией ХОБЛ и АГ отмечены также изменения морфологических структур левого желудочка, в частности увеличение толщины межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ) (13,0±0,60 мм и 13,0 ± 0,52 мм), при этом у 80 % пациентов толщина МЖП достигает 16,0 мм, толщина ЗСЛЖ при тяжелой степени ХОБЛ в сочетании с АГ достигает 15 мм. Индекс корреляции МЖП и ЗСЛЖ r = 0,958. Индекс массы миокарда 146 ± 13,52 г/м2 и достигает 244 г/м2 (табл.1), что свидетельствует о значительных анатомо-морфологических изменениях в структуре миокарда левого желудочка у большинства пациентов с сочетанной патологией (80 %). Все эти показатели превышают норму и коррелируют между собой (r = 0,753) (табл.2), указывая на развитие ремоделирования миокарда левого желудочка и подтверждая наличие симметричной гипертрофии.
Таблица 2
Корреляция между показателями эхокардиографического исследования упациентов схронической обструктивной болезнью легких, артериальной гипертензией ипри сочетании этих заболеваний
|
Показатели |
ХОБЛ |
АГ |
ХОБЛ+АГ |
|
УО и КСО |
r=0,542 |
r = 0,473 |
r = 0,726 |
|
ЗСЛЖ и МЖП |
в пределах нормы |
r = 0,840 |
r = 0,958 |
|
ЗСЛЖ, МЖП и ИММЛЖ |
в пределах нормы |
r = 0,568 |
r = 0,753 |
Примечание: учитывался коэффициент корреляции rs — Спирмена при р<0,05.
Показатели толщины межжелудочковой перегородки, задней стенки и индекса массы миокарда левого желудочка у пациентов с АГ без сочетанной патологии составляют 12,8 ± 0,19 мм, 12,4 ± 0,20 мм и 119,2 ± 5,73 г/м2 (табл.1) соответственно, что в меньшей степени отклоняется от нормы по сравнению с группой пациентов с сочетанной патологией. При этом показатели толщины МЖП, ЗСЛЖ, ИММЛЖ у пациентов с ХОБЛ без патологии сердечно-сосудистой системы находятся в пределах нормальных значений.
У пациентов с коморбидностью ХОБЛ и АГ наблюдается увеличение правых отделов сердца. Правое предсердие увеличено в основном по длинной оси (52,0 ± 1,95мм и 40,0±2,06мм длинная и короткая ось соответственно). Размеры правого предсердия у групп сравнения находятся в пределах нормы. Увеличение правого желудочка в группе пациентов ХОБЛ и АГ выражено в большей степени, чем у пациентов с изолированной ХОБЛ. Толщина стенки правого желудочка в группе ХОБЛ с АГ увеличена и составляет 6 ± 0,52 мм, в то время как толщина стенки правого желудочка при изолированной ХОБЛ изменена в меньшей степени 5,85 ± 1,15 мм. Полость правого желудочка расширена и соответствует 30 ± 1,67 мм и 43,0 ± 3,0 мм по парастернальной и Ч-К-позиции соответственно. При АГ толщина стенки ПЖ соответствует норме. При тяжелой степени ХОБЛ в сочетании с АГ диаметр НПВ увеличен у 53 % пациентов в сравнении с другими группами пациентов и контрольной группой, и у 13 % пациентов достигает 27 мм, что свидетельствует о развитии застойных явлений по большому кругу кровообращения, в то время, как при изолированной патологии — ХОБЛ или АГ — не изменен и составляет 19,0 ± 2,0 мм и 18,7 ± 0,52 мм соответственно (табл.1).
У больных с сочетанной патологией наблюдается увеличение диаметра легочной артерии (26,0 ± 1,46 мм), что является качественным признаком развития легочной гипертензии (ЛГ). Систолическое давление в легочной артерии увеличено в основном до уровня умеренной легочной гипертензии (49,0 ± 9,21 мм.рт.ст.), что свидетельствует о снижение толерантности сосуда к функциональным нагрузкам и способствует структурным изменениям правых отделов сердца в связи с легочным сопротивлением.
Обсуждая полученные результаты, мы обнаруживаем при коморбидности ХОБЛ и АГ более яркую картину клинических проявлений и значительное увеличение морфологических и функциональных изменений сердца, нежели при ХОБЛ без кардиоваскулярной патологии или только при АГ. При сочетанной патологии выявлены повреждения всех отделов сердца, как предсердий, так и желудочков, гипертрофия миокарда обоих желудочков и межжелудочковой перегородки, обуславливая тем самым более выраженное ремоделирование миокарда, и развитие диастолической дисфункции, в основном по типу замедления релаксации.
При сочетанной патологии нами выявлены как качественные (диаметр легочной артерии 26,0 ± 1,46 мм), так и количественные (СДЛА 49,0 ± 9,21 мм.рт.ст.) признаки развития легочной гипертензии, соответствующие в основном уровню умеренной ЛГ. Кроме того у пациентов с коморбидностью ХОБЛ и АГ, в отличие от других групп (табл.1), мы выявили увеличение диаметра НПВ, в 13 % случаев до 27 мм, недостаточное ее спадение (менее чем на половину) на вдохе, свидетельствующие о развитии застойных явлений по большому кругу кровообращения, что является признаком декомпенсации хронической сердечной недостаточности на фоне имеющегося хронического легочного сердца и неблагоприятного прогноза.
Согласно данным [9], прослеживается достоверная связь между индексом повреждения миокарда Cardiac Infarction Injury Score (CIIS) с давлением в легочной артерии, конечным диастолическим размером правого и левого желудочков, фракцией выброса левого желудочка и как результат — риском смерти пациентов с ХОБЛ.
Нужно обратить внимание на некоторые изменения сердечно-сосудистой системы, которые отсутствуют при АГ, но имеют место быть при ХОБЛ [3]. Прогрессирование заболевания дыхательной системы не только усугубляет тяжесть его течения, но и вызывает развитие новых патологий другой системы. Это свидетельствует об отягощении заболеваний, увеличении фаз обострения и прогрессировании как самой ХОБЛ, так и АГ на ее фоне.
В последнее время обсуждается тот факт, что наличие кардиоваскулярной патологии при ХОБЛ не простая случайность, ассоциация, а результат наличия ряда общих факторов патогенеза.
В основе большинства патогенетических механизмов развития АГ при ХОБЛ лежит эндотелиальная дисфункция, вызванная разными патофизиологическими процессами. В основе развития АГ лежит возникающая при ХОБЛ гипоксия, сосудистый ответ на нее включает несколько элементов: цитокины, мессенджеры и другие БАВ, которые регулируют межклеточные взаимодействия, и непосредственно сам комплекс межклеточных взаимоотношений.
Гипоксия способствует гипертрофии и гиперплазии эндотелия и субэндотелиальных слоев, чем вызывается утолщение интимы эндотелия, а, соответственно, нарушается его функциональная активность. Помимо утолщения непосредственно интимы эндотелия, гипоксия нарушает баланс системы коагулянтов и антикоагулянтов, что приводит к повышению секреции тромбоксана А2, увеличению агрегационной способности тромбоцитов и прокоагулянтной активности эндотелия. Этим объясняется тенденция к образованию тромбов, нарушение функциональной способности эндотелия и невозможность полноценного кислородообеспечения тканей и органов и самой сердечной мышцы в частности.
Изменения, происходящие в организме, приводят к развитию оксидативного стресса. Продукты перекисного окисления липидов стимулируют активацию протеинкиназы С и запускают каскад реакции, в результате чего мобилизуется кальций и активируется фосфолипаза А2. Фосфолипаза А2 запускает каскад арахидоновой кислоты либо по 5-липооксигеназному, либо по циклооксигеназному пути. Именно с этим связывают индукцию бронхоспазма, фазу обострения ХОБЛ, увеличение агрегационной способности тромбоцитов и другие эффекты, которые, в конечном счете, приводят к усугублению течения ХОБЛ и развитию коморбидных патологий. Мобилизация кальция приводит к нарушению ангиогенеза и индукции апоптоза.
Как результат вышеперечисленных процессов возникает сосудистый ответ в дополнение к имеющемуся воспалительному процессу в лёгких. Отмечается повышение количества нейтрофилов, макрофагов и Т-лимфоцитов, провоспалительных цитокинов (лейкотриен В4, ФНО-а, ИЛ-8) и молекул адгезии на поверхности эндотелия и нейтрофилах, что приводит к местному и системному воспалению. Наличие циркулирующих клеток и медиаторов воспаления приводит к повреждению сосудистой стенки. При этом данные изменения и развитие системного воспаления происходит и вне фазы обострения ХОБЛ [3].
При изучении взаимосвязи эндотелиальной дисфункции и процессов воспаления методами количественного определения маркеров были выявлены определенные взаимосвязи. Между маркерами эндотелиальной дисфункции КЭФ (коэффициентом эндотелиальной функции), натрийуретическим пептидом типа С (НУПС) и маркерами воспаления С — реактивный протеином и фракталкином были выявлены обратные корреляционный связи. Между уровнем вазоконстриктора эндотелина — 1 и С — реактивным протеином и фракталкином были выявлены прямые корреляционные связи. Данные сведения свидетельствуют, что воспаление играет немаловажную роль в развитии артериальной гипертензии через повреждение эндотелия сосудов, нарушение его вазодилатирующей функции, повышение выработки вазоконстрикторов [7,8]. Выраженность системной воспалительной реакции организма при ХОБЛ является определяющим фактором в развитии эндотелиальной дисфункции и коморбидных патологий. Кроме того, при сочетанной патологии имеет место повышение уровня маркеров воспаления, в частности фракталкина, в сравнении с мононозологией. [8]
Факторами риска развития кардиоваскулярной патологии при ХОБЛ являются возраст, ожирение, наличие эндокринных заболеваний и, что важно, вредные привычки, такие, как курение и др. [3].
Большинство пациентов с ХОБЛ — активные курильщики. Курение играет огромную роль в развитии эндотелиальной дисфункции. Курение влияет на вазодилатирующую функцию эндотелия, причем индекс курящего человека имеет обратную корреляционную связь с вазодилатирующей функцией эндотелия. Токсичные вещества, содержащиеся в табачной дыме, и активные формы кислорода вызывают развитие оксидативного стресса, активируют перекисное окисление липидов и усугубляют процесс системного воспаления при ХОБЛ, который протекает даже вне фазы обострения [3].
Выводы. При коморбидности ХОБЛ и АГ отмечается значительное увеличение морфологических и функциональных изменений сердца, нежели при ХОБЛ без кардиоваскулярной патологии или только при АГ. При сочетанной патологии выявлены повреждения всех отделов сердца, как предсердий, так и желудочков, гипертрофия миокарда обоих желудочков и межжелудочковой перегородки, обуславливая тем самым более выраженное ремоделирование миокарда, и развитие диастолической дисфункции.
При сочетанной патологии нами выявлены как качественные, так и количественные признаки легочной гипертензии, соответствующие в основном уровню умеренной. Кроме того, у пациентов с коморбидностью ХОБЛ и АГ, в отличие от других групп, мы выявили признаки декомпенсации хронической сердечной недостаточности на фоне имеющегося хронического легочного сердца, что является предиктором неблагоприятного прогноза.
Литература:
- Туев А. В. Хронические бронхообструктивные заболевания и сердечно-сосудистая система / А. В. Туев, В. Ю. Мишланов.- Пермь, 2008.- 184с.
- Мишланов В. Ю. Клинико-гомеостатические и терапевтические аспекты у больных с воспалительными заболеваниями системы дыхания/Мишланов В. Ю. Автореф.дис. … д-ра мед.наук. — Пермь, 2002.-44с.
- Кароли Н. А., Ребров А. П. Хроническая обструктивная болезнь легких и кардиоваскулярная патология //Клиницист. — 2007. — №. 1.
- А. Г. Чучалин. Хроническая обструктивная болезнь легких и сопутствующие заболевания//Терапевтический архив.-2013-№ 8-с.43–48
- Коваленко В. Н., Несукай Е. Г., Титов Е. Ю. Приобретенный аортальный стеноз: вопросы этиологии и патогенеза //Украинский кардиологический журнал. — 2010. — №. 1. — С. 96–103.
- Абдуллаев Ш. А., Шукурова С. М., Почоджанова Ш. Ш. Хроническая обструктивная болезнь лёгких: факторы риска и лёгочная реабилитация //Вестник Авиценны. — 2013. — №. 2. — С. 160–166.
- Ахминеева А. Х. и др. Корреляционные взаимосвязи между показателями системного воспаления и маркерами эндотелиальной дисфункции при коморбидных состояниях //Сибирский медицинский журнал (Иркутск). — 2013. — Т. 122. — №. 7.
- Ахминеева А. Х. и др. Роль фракталкина как маркера воспалительной активации при сочетанной респираторно-кардиальной патологии //Кубанский научный медицинский вестник. — 2014. — №. 1.
- Кароли Н. А., Ребров А. П. Индекс повреждения миокарда CIIS и смертность пациентов с хронической обструктивной болезнью легких //Кардиология. — 2008. — Т. 48. — №. 7. — С. 48–51.











