Выбор оптимального метода составления окислительно-восстановительных реакций при изучении курса «Общая химия»
Авторы: Гареев Ильнур Наилевич, Григорьева Ольга Сергеевна
Рубрика: 9. Педагогика высшей профессиональной школы
Опубликовано в
международная научная конференция «Проблемы и перспективы развития образования» (Пермь, апрель 2011)
Статья просмотрена: 7695 раз
Библиографическое описание:
Гареев, И. Н. Выбор оптимального метода составления окислительно-восстановительных реакций при изучении курса «Общая химия» / И. Н. Гареев, О. С. Григорьева. — Текст : непосредственный // Проблемы и перспективы развития образования : материалы I Междунар. науч. конф. (г. Пермь, апрель 2011 г.). — Т. 2. — Пермь : Меркурий, 2011. — С. 58-60. — URL: https://moluch.ru/conf/ped/archive/17/392/ (дата обращения: 24.04.2025).
Подбор метода для уравнивания реакций является актуальной задачей для преподавателя общехимических дисциплин, особенно на начальных курсах вузов, так как при изучении раздела окислительно-восстановительные реакции (ОВР) определяющим фактором является умение определять стехиометрические коэффициенты. Существует несколько методик составления ОВР, остановимся на наиболее известных.
Математический метод на основе материального баланса
Положение атомно-молекулярного учения о том, что атомы при химических реакциях не изменяются, не совсем верное. Атомы вследствие химических реакций изменяют свое строение: превращаются в ионы или видоизменяют электронное строение в процессе образования новых молекул. Более правильным является утверждение, что элемент во время химических реакций не изменяется. Это утверждение можно представить в виде двух правил закона сохранения количества вещества элемента (материальный баланс):
количество вещества каждого элемента до реакции равняется количеству вещества каждого элемента после реакции;
общее количество вещества всех элементов до реакции равняется общему количеству вещества всех элементов после реакции.
Изложенные правила дают возможность уравнивать уравнения любых реакций (в том числе и окислительно-восстановительных) математическим методом. Для этого необходимо записать уравнение реакции в общем виде, на основе материального баланса составить систему математических уравнений и решить ее. Рассмотрим этот метод на конкретном примере: xH2 + yO2 = zH2O,
где x, y, z – коэффициенты, показывающие число молекул (количество вещества) водорода, кислорода и воды, участвующие в реакции. Коэффициенты – целые положительные числа. Записывается уравнение закона сохранения количества вещества для каждого элемента: для H: 2x = 2z => x=z.
для O: 2y = z => y=0,5z.
Подставляются полученные значения для x, y в уравнение: zH2 + 0,5zO2=zH2O
Выносится общий множитель 0,5z и сокращается на него. Получается: 2H2+O2=2H2O
Правило второго закона сохранения количества вещества элемента можно использовать для проверки правильности выполненной работы: 2∙2+1∙2=2∙(2+1); 6=6.
Метод электронного баланса
Метод электронного баланса уравнивания окислительно-восстановительных реакций заключается в выполнении следующего правила: число электронов, отданных всеми частицами восстановителей, всегда равно числу электронов, присоединенных всеми частицами окислителей в данной реакции [1].
Уравнивание ОВР этим методом требует знания формул исходных веществ и продуктов реакции, умения рассчитывать степени окисления элементов в молекулах и ионах и строгого соблюдения очередности действий. Проиллюстрируем это на конкретном примере окисления сульфита калия дихроматом калия в кислой среде.
1. Сначала определяют изменяющиеся степени окисления элементов:
K2Cr2+6O7 + K2S+4O3 + H2SO4 => Cr2+3(SO4)3 + K2S+6O4 + H2O
2. Затем составляется электронный баланс. Для этого подсчитывают число электронов, которое нужно присоединить всеми атомами окислителя входящими в состав молекулы-окислителя, и прибавляют их число в левой части схемы процесса восстановления. В результате получаем: 2 Cr+6 + 6e- = 2 Cr+3 | 1
S+4 - 2e- = S+6 | 3
3. Полученные коэффициенты ставим перед окислителем и восстановителем в левой части уравнения и перед продуктами их восстановления и окисления – в правой части уравнения:
K2Cr2O7 + 3K2SO3 + H2SO4 => Cr2(SO4)3 + 3K2SO4 + H2O
4. Уравнивают ионы веществ, не изменяющие своей степени окисления, и подбирают недостающие коэффициенты:
K2Cr2O7 + 3K2SO3 + 4H2SO4 => Cr2(SO4)3 + 4K2SO4 + 4H2O
Следует отметить, что этот метод занимает много времени и очень затруднителен для студентов, не знающих химию.
Метод электронно-ионного баланса (метод полуреакций)
Метод применяется для уравнивания реакций, протекающих в растворах [2]. При этом отпадает необходимость в определении степеней окисления. Часто при уравнивании этим методом сначала неизвестны и продукты реакции – они выявляются в ходе самого уравнивания. Однако для правильного применения этого метода необходимо уметь записывать ионно-молекулярные реакции.
Нетрадиционный метод Гарсиа
Существует малоизвестный метод Арсесио Гарсиа составления уравнений химических реакций. Он довольно прост, не требует математической подготовки и знаний по теории окислительно-восстановительных реакций. Им может воспользоваться любой студент и получить хорошие результаты даже при уравнении сложных уравнений, межмолекулярных окислительно-восстановительных реакций. Для уравнения уравнений реакций этим методом применяется формальный атом элемента. Им может быть любой элемент, но чаще всего – кислород, так как он входит в состав большинства веществ. В отличие от реального атома, действительно существующего и могущего вступать в реакции, формальный атом используется лишь для сравнения уравнений химических реакций. Схему уравнения реакции, показывающую вещества, которые реагируют и образуются, делят на две полуреакции. В первую входят вещества, образованные одинаковыми элементами, кроме формального элемента и водорода. Остальные вещества образуют вторую полуреакцию. В случае добавления полуреакций необходимо умножить их на множители так, чтобы атомы формального элемента сократились. Рассмотрим этот метод на конкретном примере: в реакцию вступают 2 вещества:
Cu2S + HNO3 => Cu(NO3)2 + H2SO4 + NO + H2O
Составим первую полуреакцию. Выберем вещества, образованные элементами, которые составляют азотную кислоту. Уравняем водород, потом азот и, наконец, кислород, прибавив в правую часть три формальных атома кислорода O:
2HNO3 => 2NO + H2O + 3O
Вторая полуреакция образована элементами, которые составляют сульфид меди (I):
Cu2S=> 2Cu(NO3)2 + H2SO4
Уравняем атомы меди и серы. Поскольку в правой части этой полуреакции есть остаток азотной кислоты и водород, прибавим в левую часть молекулы азотной кислоты:
Cu2S + 4HNO3 => 2Cu(NO3)2 + H2SO4
Уравняем остатки азотной кислоты, потом водород, прибавив в правую часть молекулу воды, и наконец – кислород, прибавив в правую часть 5 формальных атомов кислорода:
5O + Cu2S + 4HNO3 => 2Cu(NO3)2 + H2SO4 + H2O
Прибавив 2 полуреакции, предварительно помножив первую на 5, а вторую – на 3. При этом формальные атомы кислорода сократятся. Получаем:
3Cu2S + 22HNO3 => 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O
Анализ литературы и существующие сложности, с которыми сталкиваются учащиеся при изучении раздела «окислительно-восстановительные реакции» в курсе общей химии, определили цель нашего исследования. Цель заключается в выявлении оптимального метода составления ОВР при изучении общехимических дисциплин. Нами проводился педагогический эксперимент среди студентов первого курса, обучающихся по специальности «Проектирование, сооружение и эксплуатация газонефтепроводов и газонефтехранилищ» в Альметьевском государственном нефтяном институте.
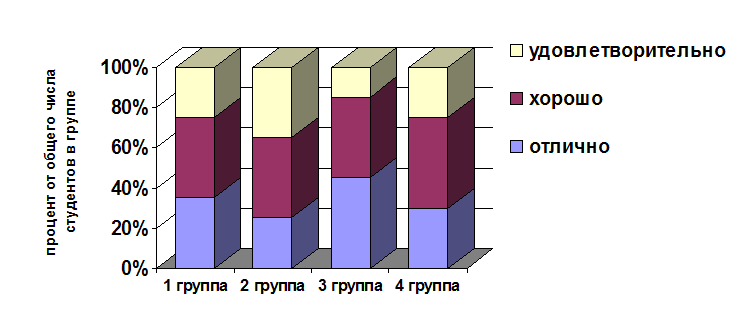
В эксперименте участвовало 60 студентов. Были выбраны 4 группы студентов. Студенты первой группы (1Г) составляли ОВР с использованием математического метода. Студенты второй группы (2Г) составляли уравнения ОВР, используя нетрадиционный метод Гарсиа. Студенты третьей группы (3Г) изучали ОВР с использованием электронно-ионного баланса. Студенты четвертой группы (4Г) изучали ОВР с использованием метода электронного баланса, который преподается в средней школе. По окончании изучения указанной темы было организовано тестирование, которое показало, что качество усвоения учебного материала, скорость решения поставленных задач варьируются у студентов разных групп, участвующих в эксперименте. Данные, отражающие результаты исследования приведены в виде диаграммы.
В итоге нами были сделаны выводы, касающиеся влияния выбора метода составления ОВР на качество усвоения теоретического аспекта выбранной темы курса общей химии. Студенты третьей группы (3Г) показали лучшие результаты по сравнению со студентами, изучающими ОВР с применением электронного баланса (4Г), нетрадиционного метода Гарсиа (2Г) и математического метода (1Г).
Объяснение данного факта можно найти в преимуществах метода составления ОВР электронно-ионным балансом, а также доступности его при изучении курса общей химии.
Литература:
1. Глинка Н. Л. Общая химия: учебное пособие для вузов / Н. Л. Глинка. – М. : Интеграл-Пресс, 2000. – 728 с.
2. Габриелян О. С. Химия: пособие для школьников старших классов и поступающих в вузы / О. С. Габриелян, И. Г. Остроумов. – М. : Дрофа, 2005. – 703 с.
Похожие статьи
Разработка методик атомно-силовой микроскопии при решении задач материаловедения микро- и наносистем
Метод физико-химического анализа при расчете числа теоретических ступеней контакта ректификации
Целью настоящего доклада является довести до молодых исследователей основы физико-химического анализа (ФХА) применительно к некоторым проблемам процессов нефтепереработки. Для интересующих углубленного изучения индивидуально предлагается информация ...
Похожие статьи
Разработка методик атомно-силовой микроскопии при решении задач материаловедения микро- и наносистем
Метод физико-химического анализа при расчете числа теоретических ступеней контакта ректификации
Целью настоящего доклада является довести до молодых исследователей основы физико-химического анализа (ФХА) применительно к некоторым проблемам процессов нефтепереработки. Для интересующих углубленного изучения индивидуально предлагается информация ...