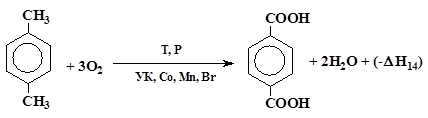Значение и получение терефталевой кислоты
Автор: Хатмуллина Диана Данисовна
Рубрика: 14. Общие вопросы технических наук
Опубликовано в
Дата публикации: 19.09.2013
Статья просмотрена: 16691 раз
Библиографическое описание:
Хатмуллина, Д. Д. Значение и получение терефталевой кислоты / Д. Д. Хатмуллина. — Текст : непосредственный // Технические науки: традиции и инновации : материалы II Междунар. науч. конф. (г. Челябинск, октябрь 2013 г.). — Т. 0. — Челябинск : Два комсомольца, 2013. — С. 86-88. — URL: https://moluch.ru/conf/tech/archive/87/3632/ (дата обращения: 24.04.2025).
Полимерные материалы и среди них химические волокна настоятельно входят в быт человека. До начала XX столетия применялись только те из них, которые являлись продуктами растительного и животного происхождения (хлопок, шерсть, лубяные волокна и т. д.). С появлением синтетических волокон последние стали быстро вытеснять натуральные волокна.
Важнейшими мономерами для производства полиэфирных волокон являются терефталевая кислота (ТФК) и диметилтерефталат (ДМТ).
Терефталевая кислота является одним из важнейших химических продуктов, используемых для производства полиэфирных волокон, полиоксадиазолов, полибензимидазолов, алкидных смол. Терефталевая кислота обладает большой прочностью, относительно высокой термостойкостью, а также высокие диэлектрические характеристики,которые позволяют применять полиэфирные материалы для производства шинного корда, транспортерных лент, приводных ремней, парусов, пожарных рукавов, электроизоляционных и других материалов. Из полиэфирных волокон (лавсан, терилен, дакрон) можно получать разнообразные материалы — длинный ворс, напоминающий мех, подходит для пошива пальто, курток, ковриков для ванной или мягких игрушек, а грубое прочное волокно пригодно для изготовления клиновых ремней, пожарных рукавов и ковровых покрытий.
Благодаря высокой устойчивости к сминанию и способности сохранять форму, хорошему внешнему виду и достаточно низкой стоимости полиэфирные волокна в чистом виде или в смеси с другими волокнами используют для изготовления широкого ассортимента товаров народного потребления: платяной и костюмной тканей, верхнего трикотажа, занавесей, постельного белья, изделий из искусственной замши и искусственного меха.
Приведенные выше свойства полиэфирных волокон обусловили наиболее крупнотоннажное производство по сравнению с производством волокон других видов.
Терефталевая кислота (1,4-бензолдикарбоновая кислота, п-фталевая кислота) является основным исходным продуктом для получения полиэтилентерефталата (ПЭТФ), гранулят которого в свою очередь используется для производства искусственного волокна, пластиковых бутылок, пленки, пластмассы.
Сырьем для производства терефталевой кислоты могут служить разные п-диалкилбензолы: п-ксилол, п-цимол, п-диэтил- и п-диизопропилбензол, а в последнее время применяется также толуол. Из окислителей наибольшее значение имеют азотная кислота и молекулярный кислород.
Из n-диалкилбензолов лучшим сырьем для окисления в терефталевую кислоту является п-ксилол. Он более доступен и, кроме того, при жидкофазном окислении п-ксилола молекулярным кислородом образуется преимущественно п-толуиловая кислота, для дальнейшего окисления которой требуется менее жесткие условия, чем для окисления промежуточных продуктов, образуемых другими n-диалкилбензолами.
В связи с развитием нефтехимической промышленности и значительным увеличением производства п-ксилола в известной степени утратили свое практическое значение способы получения диметилтерефталат (ДМТ) из толуола и п-цимола. Все большее значение приобретают процессы, позволяющие получать ТФК методом жидкофазного каталитического окисления п-ксилола с последующей ее этерификацией метанолом до ДМТ.
Процесс получения органической кислоты (терефталевой), далее технической терефталевой кислоты (ТФК) основан на реакции жидкофазного окисления параксилола (PX) кислородом воздуха в среде реакционного растворителя (RQ). В качестве катализатора используется раствор смеси кобальта (II) уксуснокислого 4‑водный и марганца (II) уксуснокислого 4-водный с добавлением промотора в виде тетрабромэтана (ТБЭ).
Брутто-реакция образования ТФК описывается схемой (1):
|
|
(1)
Тепловой эффект реакции Qp = (-∆Hр) = 326 ккал/г-моль.
Процесс проводят при температуре 185÷195°С под давлением 0,9÷1,1 МПа. Теплосъем — за счет испарения реакционного растворителя (уксусной кислоты) и реакционной воды, то есть процесс осуществляется «на кипу» при температуре, определяемой давлением (упругостью паров воды и уксусной кислоты с учетом наличия в паровой фазе инертов).
Механизм реакции — радикально-цепной с короткой цепью. Упрощенно реакцию можно рассматривать как последовательно-параллельную:
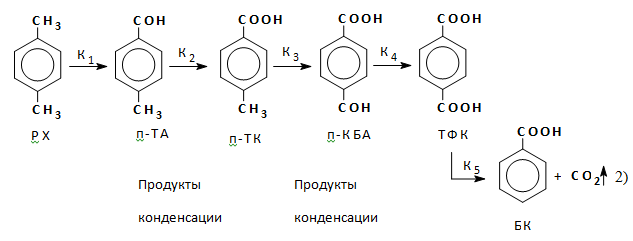
где РХ — параксилол, С6Н4 (СН3)2,
п-ТА — пара-толуиловый альдегид, п-С6Н4(CH3)СОН,
п-ТК — пара-толуиловая кислота, п-С6Н4(CH3)СООН,
п-КБА — пара-карбоксибензальдегид, п-С6Н4(СОН)СООН,
ТФК — терефталевая кислота, п-С6Н4(СООН)2,
БК — бензойная кислота, С6Н5СООН,
Кi — константа скорости I стадии реакций окисления.
Кроме образования бензойной кислоты и продуктов конденсации, основной побочной реакцией является деструктивное окисление уксусной кислоты и образование метилацетата (МА):
|
СН3СООН + 2О2 |
® |
2СО2 + 2Н2O |
(3) |
|
2СН3СООН + 3О2 |
® |
2СО2 + 2СО + 4Н2O |
(4) |
|
2СН3СООН + ½О2 |
® |
СН3СООСН3 + Н2O +СО2 |
(5) |
|
2Со(СН3СОО)3 |
® |
2Со(СН3СОО)2 + СН3СООСН3 + СО2 |
(6) |
Значение констант скоростей последовательных реакций по схеме (2), при равных значениях концентраций реагирующих компонентов, располагаются в следующей последовательности:
К2>К4>>K1>>К3 (7)
Как видно из зависимости (7), лимитирующей стадией реакции является окисление п-ТК в п-КБА, поэтому процедура оптимизации процесса окисления, в конечном итоге, должна быть направлена на обеспечение благоприятных условий для увеличения скорости реакции К3.
На процесс окисления параксилола оказывают влияние различные факторы:
1. Влияние катализатора
Увеличение концентрации катализатора и промотора существенно повышает общую скорость процесса.
Оптимальная комбинация кобальта (II) уксуснокислого 4-водного, марганца (II) уксуснокислого4-водного, тетрабромэтан ускоряет лимитирующую стадию процесса, позволяя уменьшить температуру реакции и улучшить качество ТФК, особенно по цвету.
2. Влияние температуры и давления
Температура процесса поддерживается посредством регулирования давления в реакторе окисления сбросом абгазов в систему очистки. Повышение температуры в области 180÷230°С ускоряет процесс окисления, повышая конверсию параксилола, что уменьшает содержание примесей в ТФК. Но с ускорением скорости основного процесса повышение температуры увеличивает скорость побочных процессов деструкции уксусной кислоты, параксилола и промежуточных продуктов окисления с образованием СО2 + СО. При высоких температурах (200÷230°С) повышение температуры на 10°С увеличивает содержание СО2 + СО в абгазах почти в два раза. В области низких температур (менее 200°С) образование СО2 + СО идет, в основном, за счет разложения уксусной кислоты. При более высокой температуре возрастает доля СО2 + СО, образующихся за счет деструкции параксилола и продуктов его окисления.
3. Влияние концентрации воды в реакционной массе
При высоких концентрациях вода оказывает дезактивирующее влияние на катализатор. Наличие ионов марганца повышает устойчивость каталитической системы к действию воды. Концентрация воды влияет на концентрацию кислорода в паро-газовой фазе и на образование СО2 + СО. Область оптимальных концентраций Н2О, в которой образуется минимальное количество СО2 + СО, лежит в пределах 6÷10,5 % (предпочтительно 8÷10 %), низкое значение Н2О заметно повышает содержание
СО2 + СО.
4. Влияние среднего времени пребывания жидких реагентов (удельной нагрузки по параксилолу)
При увеличении удельной нагрузки по параксилолу среднее время пребывания жидких реагентов τср уменьшается, что приводит к уменьшению конверсии параксилола. При этом в реакционной массе концентрация промежуточных продуктов окисления, в том числе и пара-карбоксибензальдегид, увеличивается, кристаллизация идет при повышенном концентрационном фоне по пара-карбоксибензальдегиду, что приводит к повышению содержания пара-карбоксибензальдегида в ТФК.
Так как τср, или удельная нагрузка по параксилолу, определяет съем ТФК с единицы реакционного объема, то определение оптимального τср является, в основном, экономической задачей — в промышленных условиях τср≈30÷120 минут в зависимости от температуры реакции.
На основании вышеизложенного приводятся оптимальные параметры процесса:
|
– давление в реакторе 1TD‑201, МПа |
0,9÷1,1 (оптимальное — 1,02) |
|
|
– температура в реакторе 1TD‑201, °С |
185÷195 (оптимальное — 186) |
|
|
– соотношение уксусной кислоты к параксилолу |
5÷6/1 (оптимальное — 5,4/1) |
|
|
– время пребывания в реакторе 1TD‑201, минут |
60 |
|
|
– концентрация в исходной реакционной смеси: — катализатора (кобальт (II) уксуснокислого и марганец (II) уксуснокислого), % масс, в пределах |
0,30÷0,40 |
|
|
– тетрабромэтана, % масс, в пределах |
0,08÷0,10 |
|
|
– силиконового масла, ppm, в пределах |
8÷10 |
|
|
– воды, % масс, в пределах |
5÷6 |
|