Системно-деятельностный подход на уроках химии
Автор: Петров Николай Константинович
Рубрика: Методика преподавания учебных дисциплин
Опубликовано в Школьная педагогика №1 (14) март 2019 г.
Дата публикации: 16.02.2019
Статья просмотрена: 480 раз
Библиографическое описание:
Петров, Н. К. Системно-деятельностный подход на уроках химии / Н. К. Петров. — Текст : непосредственный // Школьная педагогика. — 2019. — № 1 (14). — С. 32-36. — URL: https://moluch.ru/th/2/archive/116/3958/ (дата обращения: 10.04.2025).
Пояснение к разработке:
В качестве примера предлагаю урок химии в 8 классе по теме «Химические уравнения. Вычисления по химическим уравнениям». Урок является логическим продолжением темы «Химические уравнения».
Уровень знаний учащихся на момент проведения данного урока:
1) Имеется полное представление о химических формулах и их составлении согласно валентности элементов и групп атомов;
2) Полностью сформированы навыки составления формулы вещества по названию и умение давать название по формуле;
3) Сформировано представление о типах химических реакций и умение определять тип реакции по уравнению;
4) Сформированы навыки вычисления молярных масс веществ по химическим формулам, вычисления массовых долей элементов по формуле вещества;
5) Сформировано и закреплено на предыдущих уроках представление о последовательности действий (алгоритме) в проведении вычислений по уравнениям;
6) Известен закон Авогадро.
Таким образом, данный урок можно рассматривать как урок реализации учащимися полученных знаний по данной теме.
Общая структура урока:
1) Урок состоит из экспериментальной и вычислительной частей;
2) Класс делится на две группы равные по уровню знаний (т. е. есть ученики, обладающие хорошей подготовкой и уровнем знаний, а есть менее подготовленные). Группы по 4–5 человек (малокомплектный класс).
Менее подготовленные выполняют экспериментальную часть, а другие, теоретическую.
3) Каждой группе даётся задание экспериментально-вычислительного характера в форме карточки задания (или кейса) в которой прописано само задание и все этапы выполнения, цель и задачи. Выполнение задания каждой группой рассчитано на 15–20 минут, а затем, по группам, производится защита своей работы;
4) Результат защиты анализируется учителем с привлечение учащихся другой группы, объявляется результат, выставляются оценки.
В процессе выполнения заданий учитель участия не принимает, а лишь наблюдает за ходом выполнения работы. Ученики, в соответствии с заданием должны самостоятельно и грамотно провести эксперимент, провести вычисления, сделать заключение по своей работе.
План урока
Цель урока:
1) Формировать у учащихся навыки самостоятельного подхода к решению поставленной задачи.
2) Научит делать выводы, анализировать результат.
Задача: Объединить интеллектуальный потенциал учеников класса в достижении поставленной цели.
- Организационный момент (1–2 мин.)
II.Основная часть урока (40 мин.):
Примечание: Все приборы и посуда из наборов «Химическая лаборатория»
Приборы и реактивы:
1) спиртовка для группы № 2
2) пробирки в штативах для пробирок (по 6 шт.)
3) колбы (50 мл.) с водой;
4) пробиркодержатели;
5) 5 % раствор BaCl2 в бутылке с крышкой-пипеткой;
6) 10 % раствор HCl в бутылке с крышкой-пипеткой;
7) сухой Na2SO4 в открытой бутылке;
8) опилки магния.
Постановка задачи. Учитель: «Перед вами на столах реактивы и приборы. Вам выданы карточки с заданиями. Ваша задача: провести эксперимент в соответствии с заданием, на его основании сделать вывод о результате, провести вычисления. Используя ваши знания в химии, составьте химические формулы предложенных веществ, уравнения проведённых химических реакций. Основываясь на уравнениях подробно запишите ход вычислений. Оформите и обоснуйте результаты эксперимента».
Карточка № 1(первая группа)
Пояснение: В бутылке (1) с крышкой-пипеткой раствор хлорида бария, а в открытой бутылке сухой сульфат натрия.
Приготовьте раствор сульфата натрия в 1/3 части пробирки, взяв 1/4 часть от его количества о бутылке. К полученному раствору прибавьте по каплям раствор хлорида бария из бутылки (1). Пронаблюдайте за результатом эксперимента, сделайте вывод, назвав признак химической реакции.
Составьте формулы исходных веществ, и, на их основании, запишите уравнение химической реакции (используйте, при необходимости, таблицу растворимости в учебнике), определите тип реакции.
Прочитайте условие задачи, выполните вычисления, используя вами составленное уравнение. Все данные внесите в карточку.
- Эксперимент
1) Результат опыта — … (появление осадка молочно-белого цвета);
2) Признак реакции — … (выпадение осадка, изменение цвета);
3) Формула хлорида бария — … (BaCl2)
9) 4)Формула сульфата натрия — … (Na2SO4)
4) Уравнение химической реакции: … (Na2SO4 + BaCl2 = 2NaCl + BaSO4↓)
5) В осадке находится вещество — … (сульфат бария)
6) Тип химической реакции — … (реакция обмена)
(курсив — предполагаемый вариант ответа)
Условие задачи: Пусть масса осадка в данном эксперименте составила 4 г, вычислите, используя уравнение реакции, массу израсходованного сульфата натрия.

Карточка № 2 (вторая группа)
Пояснение: В бутылке (2) с крышкой-пипеткой находится 10 % раствор хлороводородной кислоты (хлорид водорода для учеников 8 класса на данном этапе обучения). В открытой бутылке, опилки магния.
Возьмите в сухую пробирку опилки магния в таком количестве, чтобы слегка прикрыть дно пробирки (не более). Добавьте из бутылки (2) 2–3 мл. раствора кислоты. Наблюдайте результат эксперимента, делайте вывод, назовите признак реакции. В момент проведения реакции зажгите лучинку и поднесите её к горлышку пробирки. Сделайте вывод по результату. Вспомните, следствием чего является проявивший себя признак.
После проведённого эксперимента заполните карточку с заданием.
Эксперимент:
1) Результат опыта — … (сильное кипение);
2) Признак реакции — … (выделение газа);
3) Символ элемента магния — … (Mg);
4) Формула хлороводородной кислоты (хлорид водорода) — … (HCl);
5) Уравнение химической реакции: … (Mg + 2HCl = MgCl2 + H2↑)
6) Выделяющийся газ — … (водород);
7) Признак водорода — … (глухой хлопок);
8) Тип химической реакции — … (реакция замещения)
Курсивом выделены предполагаемые варианты ответов
Условие задачи: Предположим, что масса магния, растворённого в хлороводородной кислоте составила 10 г. Вычислите объём водорода, который должен выделиться в этом случае. Примечание: Закон Авогадро изучен и многократно применялся на предыдущих уроках в вычислениях.
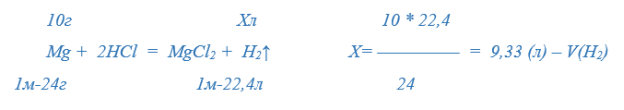
Распределение времени основной част урока: всего — 40 мин.
1) Знакомство с заданиями — 3–4 мин.
2) Выполнение практической части (аккуратно) — 10 мин.
3) Выполнение вычислений — 5–7 мин.
4) Подготовка к отчёту о проделанной работе — 3 мин.
5) отчёт о результатах работы и обсуждение — 16 мин. (8 мин. на каждую группу).
6) Отчёт о проделанной работе можно построить в форме семинара, с целью привлечения к обсуждению наибольшего количества учеников.
Учитель в этом случае выполняет функцию направляющего звена, вовлекающего в обсуждение темы всех учеников каждой из групп.
- Заключение (3мин.):
1) Подведение результатов работы;
2) Выделение лучших учеников в каждой группе;
3) Объявление итоговых оценок;
4) Домашнее задание
Карточка № 1(первая группа)
Пояснение: В бутылке (1) с крышкой-пипеткой раствор хлорида бария, а в открытой бутылке сухой сульфат натрия. Приготовьте раствор сульфата натрия в 1/3 части пробирки, взяв 1/4 часть от его количества о бутылке. К полученному раствору прибавьте по каплям раствор хлорида бария из бутылки (1). Пронаблюдайте за результатом эксперимента, сделайте вывод, назвав признак химической реакции.
Составьте формулы исходных веществ, и, на их основании, составьте уравнение химической реакции (используйте при, необходимости, таблицу растворимости в учебнике), определите её тип. Прочитайте условие задачи, выполните вычисления, используя вами составленное уравнение. Все данные внесите в карточку.
Эксперимент
1) Результат опыта — …
2) Признак реакции — …
3) Формула хлорида бария — …
4) Формула сульфата натрия — …
5) Уравнение химической реакции: …
6) В осадке находится вещество — …
7) Тип химической реакции — …
Условие задачи: Пусть, масса осадка в данном эксперименте составила 4 г, вычислите, используя уравнение реакции, массу сульфата натрия, израсходованного при этом.
Карточка № 2 (вторая группа)
Пояснение: В бутылке (2) с крышкой-пипеткой находится 10 % раствор хлороводородной кислоты (хлорид водорода для учеников 8 класса на данном этапе обучения). В открытой бутылке опилки магния.
Возьмите в сухую пробирку опилки магния в таком количестве, чтобы слегка прикрыть дно пробирки (не более). Добавьте из бутылки (2) 2–3 мл. раствора кислоты. Наблюдайте результат эксперимента, делайте вывод о том, что является признаком реакции. В момент проведения реакции зажгите лучинку и поднесите её к горлышку пробирки. Сделайте вывод о результате действия. Вспомните, следствием чего является проявивший себя признак.
После проведённого эксперимента заполните карточку с заданием.
Эксперимент:
1) Результат опыта — …
2) Признак реакции — …
3) Символ элемента магния — …
4) Формула хлороводородной кислоты (хлорид водорода) — …
5) Уравнение химической реакции: …
6) Выделяющийся газ — …
7) Признак водорода — …
8) Тип химической реакции — …
Условие задачи: Предположим, что масса магния, растворённого в хлороводородной кислоте составила 10 г. Вычислите объём водорода, который должен выделиться в этом случае.







