- Введение
Меланома — один из самых серьезных видов рака. B среднем в России, как и во всем мире, отмечается рост заболеваемости на 1,5 % в год (по данным Всемирной организации здравоохранения). Ситуация осложняется тем, что, хотя меланома визуально определима, люди часто ее не замечают и вовремя не обращаются за помощью. [1].
Таким образом, в связи с ростом темпов заболеваемости, представляется актуальным провести анализ литературных данных о различных подходах к лечению меланомы для выявления наиболее перспективных среди них.
- Меланома. Общая характеристика заболевания
Меланома — это злокачественная опухоль, возникающая из меланоцитов — клеток, содержащих пигмент меланин. В 90 % случаев меланома локализуется на кожных покровах, реже — сетчатке глаза, слизистых оболочках [2].
Меланома кожи является крайне агрессивным заболеванием, характеризующимся склонностью к быстрому распространению процесса и устойчивостью к большинству применяемых методов лечения, в связи с чем является объектом для детального изучения с применением высокотехнологичных методов.
1. Симптоматика меланомы кожи
Меланома может возникать спонтанно или развиваться из уже присутствующего невуса (родинки), трансформируя доброкачественное образование в злокачественное [2].
Ранняя диагностика меланомы существенно увеличивает шансы больного на выздоровление, поэтому важно знать признаки озлокачествления невуса, чтобы отличить обычную родинку от меланомы:
− Быстрое увеличение размеров.
− Асимметричность.
− Наличие неровных, “рваных” краев.
− Неравномерность окраски с наличием темных и голубоватых оттенков.
− Появление кровотечения, зуд, боль в области невуса [4].
Наличие этих признаков, особенно в комбинации — причина посетить врача.
2. Факторы риска развития меланомы
Не существует единого фактора развития меланомы.
Самый значимый фактор риска ненаследственных форм меланомы кожи — воздействие на кожу ультрафиолетового излучения (УФИ).
В результате прямого действия УФИ образуются циклобутановые димеры пиримидина (два основания тимина, в нормальной молекуле лежащие параллельно, сшиваются вместе, образуя циклобутановый димер). Поэтому там, где у нормальной ДНК спираль идет гладко, у поврежденной возникает изгиб. [5].
Риск меланомы возрастает даже после одного или нескольких солнечных ожогов, так как после интенсивной инсоляции верхние слои эпидермиса отмирают, из-за чего уровень защиты от мутагенного воздействия УФ снижается. А в этих условиях повреждения ДНК, в большей степени выраженные в меланоцитах, могут преобладать над процессами ее восстановления [3].
По чувствительности кожи к УФ воздействию выделяются 6 фототипов, где 1 и 2 отличаются наибольшей чувствительностью, что обусловлено преобладанием в коже феомеланина (пигмент желтого цвета). Он хуже поглощает УФ-лучи, под действием их диссоциирует с образованием свободных радикалов, которые могут вызывать разрыв ДНК [5].
К факторам риска развития меланомы относят наличие множественных (боле 50) пигментных невусов кожи.
При изучении экспрессионного профиля с использованием биочиповых технологий показано, что 2 602 гена имеют различный уровень экспрессии в неизмененной ткани, нормальных и диспластических невусах, первичной и метастатической меланоме. Самые частые мутации — в генах BRAF, NRAS, CDKN2A (ассоциирован с риском развития семейной меланомы), KIT, MET.
Что касается генетически детерминированной меланомы, то частота заболевания у близких родственников больных составляет 8–14 % [6].
- Стадии меланомы кожи.
Меланому кожи принято разделять на 5 стадий по методике, предложенной В.Кларком в 1967 г (Табл. 1.)
Таблица 1
|
Меланома 0 |
Наличествует только в верхнем слое кожи — эпидермисе. |
|
Меланома I |
Новообразование не имеет шелушений и язв, не кровоточит. Скорость деления клеток достаточно низкая. Меланома не затрагивает органы и лимфатические узлы. |
|
Меланома II |
Опухоль проникает вглубь. Проявляется шелушение, наличие язв, порой, кровоточивость. Поражения лимфатических узлов и других органов не происходит. |
|
Меланома III |
Опухоль поражает лимфатические узлы. Они могут быть увеличены, но не всегда. Злокачественное новообразование утолщается, проникает в ткани ещё глубже. Изъявления могут также либо проявляться, либо — нет. |
|
Меланома IV |
Злокачественное новообразование уже пускает метастазы, затрагивая внутренние органы, такие как: печень, лёгкие, головной мозг. Проникает на отдалённые лимфоузлы и поражает отдельные участки кожи. |
- Способы лечения меланомы кожи
Сегодня в онкологической практике применяются три основных метода в лечении меланом:
- хирургический;
- лучевая терапия;
- лекарственная терапия (химиотерапия, таргетная, иммунотерапия).
1. Хирургический метод
Ведущий метод, который состоит в широком иссечении в пределах здоровых тканей. При этом нет единого мнения об адекватных границах иссечения меланомы кожи, метод во многом зависит от суммы прогностических факторов, определяющих риск метастазирования, возникает вопрос функционально-косметического эффекта [7].
2. Лучевая терапия
Хотя клетки меланомы обладают невысокой радиочувствительностью, при поражении кожи на конечностях можно давать достаточно высокие дозы радиации, не опасаясь действия облучения на внутренние органы. [8]. Недостатком лучевой терапии является вероятность многочисленных побочных эффектов (проблемы в работе сердечно-сосудистой системы; выпадение волос; снижение защитных функций организма) [9].
3. Лекарственная терапия
3.1 Химиотерапия
Суть метода — использование клеточных ядов или токсинов, губительно воздействующих на клетки злокачественных опухолей при сравнительно меньшем повреждении здоровых клеток; назначают на 3−4 стадии, когда метастазы широко распространились в организме [10]. Главный недостаток — побочные эффекты: тошнота; потеря волос; головная боль; влияние на кожу, раздражение слизистой мочевого пузыря, почек [10].
3.2 Таргетная терапия
Лечение препаратами, блокирующими рост и распространение раковых клеток. Применима для лечения I-III стадий меланомы [11].
Препараты таргетной терапии (Вемурафениб и Дабрафениб) — ингибиторы киназной активности BRAF (ген BRAF кодирует белок, играющий роль в регуляции сигнального пути MAP-киназы / ERK, который влияет на деление и дифференцировку клеток) [12].
Мутация в гене BRAF валина 600 в глутаминовую кислоту (V600E) является наиболее распространенной [11]. (Реализация сигнального пути BRAF и действие дабрафениба — на Рис. 1).
Побочные эффекты — фоточувствительность, из-за которой пациенты должны защищать свою кожу от УФ, сыпь, папиллома [12].
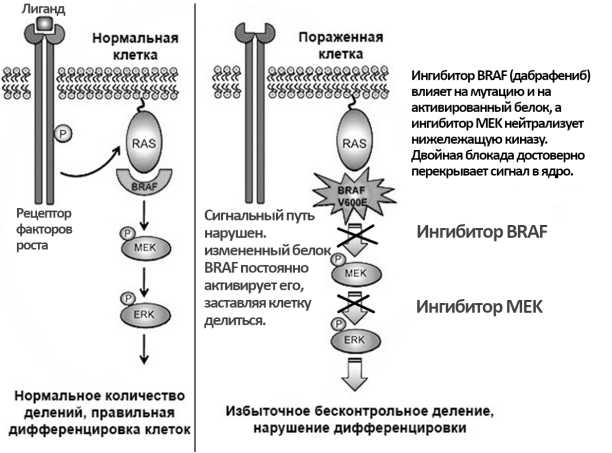
Рис. 1. Реализация сигнального пути BRAF
http://biolinklab.ru
3.3 Иммунотерапия
Использование лекарственных препаратов, обладающих способностью корректировать иммунитет. Токсичность таких препаратов ниже, чем химиотерапевтических [13].
Прорывом в иммунотерапии стали ингибиторы блокаторов иммунного ответа, селективно связывающиеся с рецепторами PD-1 и CTLA-4 на поверхности иммунокомпетентных клеток [14].
2.1.Ингибиторы СTLA4
Ингибиторы CTLA4 были одобрены в 2011г. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Их использование позволило медикам заявить о возможности излечения части больных даже на четвертой стадии заболевания, подтвердив тем самым высокий потенциал иммунотерапевтических подходов [13].
В России из таких препаратов зарегестрирован только Ипилимумаб, однако его терапевтическая эффективность сочетается с большим количеством побочных эффектов [13].
2.2.Ингибиторы PD-1
Молекула PD-1 экспрессируется на поверхности Т-, В-лимфоцитов и является негативным регулятором их функциональной активности. Лиганды (PDL1 и PDL2) располагаются на различных клетках организма, включая и иммунные [10].
Взаимодействие лигандов PD-L1 и PD-L2 с рецептором PD-1 конкурирует со стимулирующими сигналами (связыванием Т-клеточного рецептора (TCR) с главным комплексом гистосовместимости (MHC) и стимулирующими сигналами CD80/86-CD28) и снижает активность лимфоцитов [14].
Некоторые опухолевые клетки способны усиливать экспрессию PD-L1 и PD-L2, из-за чего ингибирующие сигналы преобладают и лимфоцит не атакует клетку.
Однако этот механизм можно искусственно блокировать (например, с помощью препаратов Пембролизумаб и Неволумаб), чтобы защитить лимфоцит от подавляющего действия опухолевых клеток (Рис. 2) [14].
Такие препараты должны действовать в том случае, когда установлена экспрессия лиганда PDL1 опухолевой клеткой, т. к. направлены на блокировку каскада PD1/PDL1. Но исследования доктора Даниэль С. Чена (главный медицинский директор IGM Biosciences) показали эффективность антител PD-1/PD-L1 независимо от экспрессии PD-L1. Скорее всего, это связано с тем, что PDL1 экспрессируется также в лимфоузлах и в других иммунных клетках, ограничивая их активацию [14].
Разницу ответов на ингибитор PDL1 пациентов с экспрессией PDL1 и без в 2 месяца С.Чен объяснил активацией генерации цитотоксических Т-лимфоцитов, способных распознавать и убивать опухолевые клетки. [13]. (На рис. 3 представлен жизненный цикл Т-лимфоцита).
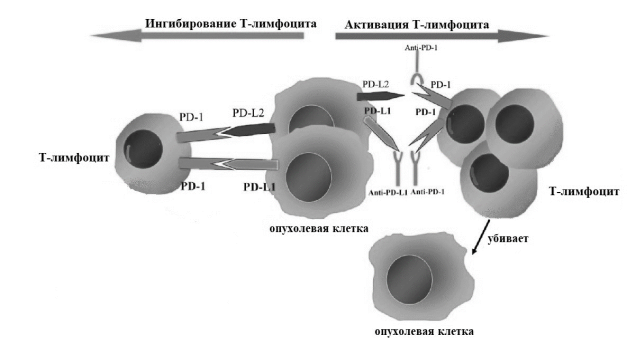
Рис. 2.. Механизм работы Анти-PD-1 и Анти-PDL1
http://biolinklab.ru
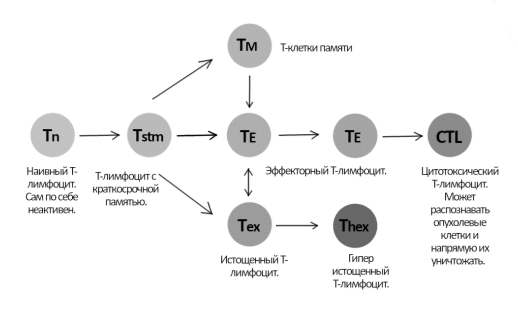
Рис. 3. Жизненный цикл Т-лимфоцита
Источник: Dieckmann N The cytotoxic T lymphocyte immune synapse at a glance, 2016
Преимуществами иммунотерапии является то, что иммунотерапия вызывает меньше побочных эффектов, чем другие виды терапии, поскольку лечение нацелено только на клетки опухоли или на определенный тип клеток иммунной системы, а не на все клетки организма; предотвращает частые рецидивы опухолей (после иммунотерапии иммунная система сохраняет способность распознавания раковых клеток и, если они появляются вновь, способна лучше с ними справляться); при лечении метастатической меланомы терапия на основе ипилимумаба и ниволумаба превосходит по эффективности стандартную химиотерапию дакарбазином [13]; [14].
Побочные эффекты иммунотерапии обычно связаны со стимуляцией иммунной системы и могут проявляться как в виде незначительного воспаления, так и в виде расстройств, сходных с аутоиммунными. [14].
Результаты проведенного сравнительного анализа различных подходов к лечению меланомы кожи представлены в сводной таблице (см. таблицу 2).
Таблица 2
|
Метод лечения |
Сущность |
Стадии МК |
3-летняя выживаемость |
Преимущества |
Побочные эффекты и риски, связанные с использованием метода |
|
Хирургический |
Радикальное удаление опухоли |
1–3 |
80–90 % (Барчук А. С. Хирургическое лечение меланом// Сибирский онкологический журнал 2001 с.70–79). |
Нередко позволяет добиться полного излечения; Существуют сберегательные операции, подразумевающие выполнение щадящего хирургического вмешательства. |
Возможность появления послеоперационных осложнений. |
|
Лучевая терапия |
Лечение ионизирующей радиацией |
3–4 |
40 % (Закурдяева И. Г. Лучевая терапия в лечении метастазов меланомы в коже, мягких тканях и висцеральных органах// Онкология. Журнал им. П. А. Герцена, 2013 с.40–44). |
Уменьшает риск рецидивирования, используется как вспомогательный метод. |
Проблемы в работе сердечно-сосудистой системы; выпадение волос; снижение защитных функций организма; появление тошноты, рвоты, диареи; проявление анемии; общей утомляемости. |
|
Химиотерапия |
Лечение с помощью введения в организм специальных химических веществ или лекарственных препаратов. |
3–4 |
10–20 % (Борова Е. А., Жеравин А. Н. Иммунотерапия меланом//Сибирский онкологический журнал, 2017 ст.65–75). |
Эффективное лечение при множественных метастазах и поражениях лимфатических узлов. |
Очень токсичная: появления тошноты, диареи; потеря волос, состояние стресса и депрессии; истощения, усталость; головная боль, нарушения координации, головокружение. |
|
Иммунотерапия |
Лечение с использованием лекарственных препаратов, обладающих способностью корректировать иммунитет. |
3–4 |
35 % (Борова Е. А., Жеравин А. Н. Иммунотерапия меланом//Сибирский онкологический журнал, 2017 ст.65–75). |
Все это позволяет остановить рост опухоли, а также предотвратить возникновение ее рецидивов. токсичность иммунотерапевтических препаратов ниже, чем химиотерапевтических. Она предотвращает частые рецидивы опухолей. После иммунотерапии, иммунная система сохраняет способность распознавания раковых клеток. |
Обычно связаны со стимуляцией иммунной системы и могут проявляться как в виде незначительного воспаления, так и в виде серьезных, сходных с аутоиммунными расстройствами. Наиболее распространенными побочными эффектами становятся: кожные реакции, язвы во рту, усталость, тошнота, боли в теле, головные боли и изменения кровяного давления. |
|
Таргетная терапия |
Лечение препаратами, которые блокируют рост и распространение раковых клеток, посредством воздействия на специфические молекулы, которые участвуют в росте и развитии опухолевой клетки. |
1–3 |
45–50 % (Simone M. Goldinger, Carla Murer, Pascale Stieger, Reinhard Dummer: Targeted therapy in melanoma — the role of BRAF, RAS and KIT mutations, 2013) |
Они могут быть эффективны против рака, который слабо отвечает на химиотерапию. У них есть конкретная «мишень». Они действуют более прицельно, поэтому вызывают меньше побочных эффектов. |
Фоточувствительность, из-за чего пациенты должны защищать свою кожу от ультрафиолета (развиваются в течение 24 часов, светлокожие люди более склонны к развитию), формирование плоскоклеточного рака (развивается через 8 недель. Быстро растет, не склонен к инвазии и метастазированию. Не зависит от дозы препарата), сыпь (развивается в среднем через 12–14 дней, дозозависимый характер), кератоакантома, папиллома (часто встречающиеся доброкачественные опухоли эпидермиса, в большей степени в зрелом возрасте). |
Был сделан вывод, что хирургический метод лечения наиболее эффективен на начальных стадиях меланомы кожи, когда нет метастазов. Таргетная терапия (с использованием дабрафениба) рекомендуется в том случае, когда есть мутация V600E в гене BRAF.
Наиболее перспективным методом лечения, согласно результатам данного обзора, является активно развивающаяся в настоящее время иммунотерапия. Главное преимущество — небольшое количество побочных эффектов по сравнению с другими методами лечения, что связано с принципом ее работы — активацией собственного иммунитета для борьбы со злокачественной опухолью.
Один из наиболее перспективных для изучения аспектов иммунотерапии рака — изучение путей стимуляции генерации цитотоксических Т-лимфоцитов из Т-лимфоцитов с краткосрочной памятью. Именно цитотоксические Т-лимфоциты дают устойчивый и долгосрочный иммунный ответ, что позволяет увеличить выживаемость онкобольных, предположительно, даже на поздних стадиях заболевания.
Литература:
- Абелев Г. И., Эрайзер Т. Л.: На пути к пониманию природы рака// Бмохимия 2008, том 73, вып. 5, с. 605–618
- C. Franklin, E. Livingstone, A. Roesch Immunotherapy in melanoma: Recent advances and future directions// EJSO 2017 604–611
- Sample A, He YY Mechanisms and prevention of UV-induced melanoma// Photodermatol Photoimmunol Photomed. 2018 с. 13–24.
- Черненко П. А., Петерсон С. Б., Любченко Л. Н. Наследственная меланома кожи: клинико-молекулярная диагностика// Российский биотерапевтический журнал 2012 с. 2–4
- Барчук А. С. Хирургическое лечение меланом// Сибирский онкологический журнал 2001 с.70–79
- https://meduniver.com/Medical/onkologia/luchevaia_terapia_melanomi.html
- Закурдяева И. Г. Лучевая терапия в лечении метастазов меланомы в коже, мягких тканях и висцеральных органах// Онкология. Журнал им. П. А. Герцена, 2013 с.40–44
- Владимирова Л. Ю. Ингибирование МАР-киназного пути в лечении метастатической меланомы кожи// Злокачественные опухоли 2015 с.12–15.
- Simone M. Goldinger, Carla Murer, Pascale Stieger, Reinhard Dummer: Targeted therapy in melanoma — the role of BRAF, RAS and KIT mutations, 2013
- Тимофеев И. В.: Меланома с мутацией Braf V600, 2017
- Орлова К. В. Адъювантная терапия меланомы. Аргументы в пользу таргетной терапии. Конференция RUSSCO «Меланома», 25 января 2019, Москва
- Park K. Combined therapy of imatinib and an anti-CTLA4 immune-checkpoint inhibitor//Journal of Controlled Release 2018
- Adedayo A. Onitilo, Jaimie A. Wittig Principles of Immunotherapy in Melanoma
- Кукушкина М.Н, Коровин С. И., Кукушкина С. Н. Иммунотерапия генерализованной меланомы кожи//Клиничская онкология 2017 ст.14–20.
- Dieckmann N, Frazer G, Asano Y, Stinchcombe J, Griffiths G. The cytotoxic T lymphocyte immune synapse at a glance, 2016










