- Введение. Свойства вещества.
Никелевый купорос (гептагидрат сульфата никеля) NiSO 4 ∙7H 2 O образует кристаллы изумрудно-зелёного цвета (рис. 1). Молярная масса M (NiSO 4 ∙7H 2 O)=280,764 г/моль, плотность составляет ρ = 1,948 г/см 3 . Данные кристаллы интересны для нас тем, что с течением времени или при нагревании могут терять кристаллизационную воду (потеря воды начинается с 31,5°C), также при прокаливании может меняться их структура. Изменения сопровождаются изменением внешнего вида кристаллов, в том числе цвета. Вещество обладает токсичностью, канцерогенностью, способно вызывать аллергические реакции. Никелевый купорос используется в производстве аккумуляторов, в фунгицидных смесях, для изготовления катализаторов, в жировой и парфюмерной промышленности.

Рис. 1. Кристалл никелевого купороса
Точечная группа симметрии никелевого купороса — D2 (международное обозначение 222), кристаллизуется с образованием следующих простых форм: ромбической призмы, ромбического тетраэдра и пинакоида (рис. 2). Отмечаются двойники прорастания по (100) и (010) В минералогии никелевый купорос известен как моренозит.
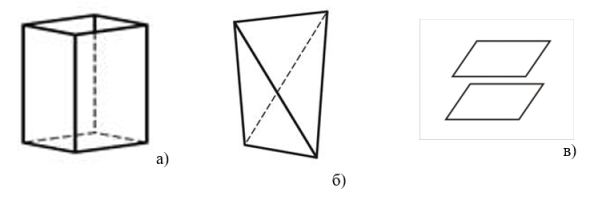
Рис. 2. Простые формы NiSO 4 ∙7H 2 O: а) ромбическая призма, б) ромбический тетраэдр и в) пинакоид
- Цель и задачи исследования
Цель данной работы — познакомиться с подходами научного эксперимента, на примере кристаллов никелевого купороса оценить качественные (текстура, цвет) и количественные (масса) изменения кристаллов в процессе нагрева и выявить возможные физико-химических закономерности.
Для этого перед нами стояли следующие задачи:
− научиться работать с лабораторным оборудованием;
− вырастить кристаллы никелевого купороса NiSO 4 ∙7H 2 O;
− показать способность монокристаллов никелевого купороса терять кристаллизационную воду при нагреве за определённые промежутки времени;
− определить массу кристалла до и после нагрева, массу потерянной кристаллизационную воды;
− научиться обрабатывать результаты эксперимента;
− сопоставить изменение массы кристалла с температурой кристалла и временем нагрева;
− выявить закономерности в скорости изменения массы кристалла и параметрами, при которых проводились эксперименты.
- Приборы и материалы для исследования
Для проведения экспериментов кроме реактива никелевого купороса нам необходимы следующие приборы и лабораторная посуда (рис. 3):
− весы электронные
− колба или мерный стакан
− плита электронагревательная
− контактный термометр (предел измерения 150°C)
− секундомер
− пинцет
− чашка Петри

а) б)
Рис. 3. Некоторые приборы, необходимые для эксперимента: а) электронные весы; б) контактный термометр
4 . Выращивание кристаллов NiSO 4 ∙7 H 2 O из растворов
Для выращивания кристаллов требуется реактив никелевого купороса (представляет собой порошок зелёного цвета (рис.4), его растворимость в воде при нормальных условиях равна 925 г/л.

Рис. 4. Реактив никелевого купороса
Выращивание проводилось методом охлаждения насыщенного водного раствора. Для приготовления раствора было взято 37 г вещества и 40 мл воды. Масса порошка измерялась на электронных весах, объём воды был определён с помощью мензурки с миллилитровыми делениями. Растворение реактива сопровождаем нагреванием на плите (необходимо для увеличения скорости растворения вещества) до полного растворения осадка. Рекомендуется добавить 10 мл воды в раствор для недосыщения нагретого раствора, который при охлаждении станет пересыщенным. После полного растворения реактива фильтруем раствор с помощью фильтровальной бумаги для избавления от твердых примесей. Сливаем очищенный раствор в чашку Петри, полностью ее не закрывая. Кристаллы растут в течение 1–2 дней. Зародыши появляются в центрах роста из пыли, которая находится в растворе. В процессе роста, по мере охлаждения раствора, кристаллы могут образовывать сростки (рис. 5).

Рис. 5. Полученные кристаллы NiSO 4 ∙7H 2 O.
5 . Ход эксперимента
Для установления зависимости массы кристалла от времени в процессе нагрева, нами был разработан следующий алгоритм:
- Выращенный методом испарения кристалл никелевого купороса NiSO 4 ∙7H 2 O помещаем в колбу (мерный стакан), взвешиваем на электронных весах (предварительно взвесив массу ёмкости), фиксируем результаты первого взвешивания, т. е. массу кристалла до нагрева.
- Ставим греться кристалл на электронагревательную плиту (в этой же ёмкости) на средний нагрев на 5 минут. Измеряем температуру кристалла с помощью контактного термометра и фиксируем результаты.
- После окончания нагрева визуально оцениваем изменения цвета кристалла и его текстуры, взвешиваем кристалл.
- Выполнение пунктов 2 и 3 теоретически возможно до полной дегидратации кристалла, время нагрева можно увеличивать, отслеживая изменение массы кристалла после каждого этапа.
По описанному выше алгоритму был проведен эксперимент с первым отобранным кристаллом (рис. 6–11). На рисунках видно, что кристалл в процессе нагрева меняет цвет от изумрудно-зеленого, желто-зеленого до желтого и даже охристого. При этом кристалл становится более рыхлым, появляются трещины, кристалл рассыпается.
|
Рис. 6. Начальная фаза кристалла |
Рис. 7. Кристалл после 1 нагрева |
|
Рис. 8. Кристалл после 2 нагрева |
Рис. 9. Кристалл после 3 нагрева |
|
Рис. 10. Кристалл после 4 нагрева |
Рис. 11. Конечная фаза |
Результаты эксперимента представлены в таблице 1. Первой строке соответствует масса кристалла NiSO 4 ∙7H 2 O до нагрева. В ходе эксперимента масса кристалла уменьшается.
Таблица 1
Результаты эксперимента № 1
|
№ |
Масса кристалла, г |
Время, мин |
Температура, ° C |
|
0 |
1,825 |
0 |
До нагрева |
|
1 |
1,772 |
5 |
92° |
|
2 |
1,699 |
5 |
95° |
|
3 |
1,678 |
5 |
114,2° |
|
4 |
1,52 |
10 |
112,5° |
|
5 |
1,4 |
10 |
120° |
|
6 |
1,375 |
10 |
Выше 120°C |
По результатам, полученным в ходе эксперимента (табл. 1), рассчитаем изменение массы кристалла и скорость изменения массы кристалла на каждом этапе эксперимента, а также суммарное время нагрева (табл. 2). Построим соответствующие графики зависимостей (рис. 12–14)
Таблица 2
|
m , г |
t , мин |
∆ m , г |
∆ m / t , г/мин |
t сум , мин |
|
1,825 |
0 |
0 |
0 |
0 |
|
1,772 |
5 |
0,053 |
0,0106 |
5 |
|
1,699 |
5 |
0,073 |
0,0146 |
10 |
|
1,678 |
5 |
0,021 |
0,0042 |
15 |
|
1,52 |
10 |
0,158 |
0,0158 |
25 |
|
1,4 |
10 |
0,12 |
0,012 |
35 |
|
1,375 |
10 |
0,025 |
0,0025 |
45 |
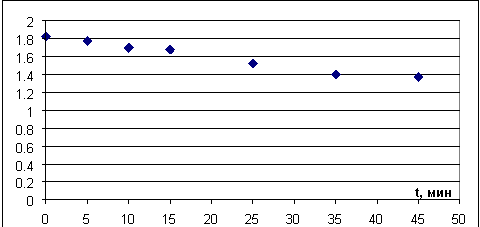
Рис. 12. График зависимости массы кристалла от суммарного времени нагрева
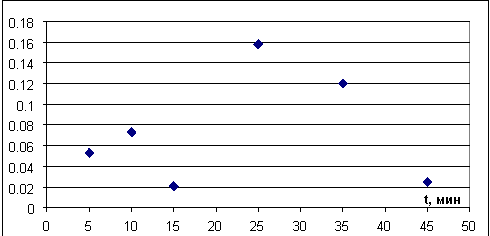
Рис. 13. График зависимости изменения массы кристалла от суммарного времени нагрева
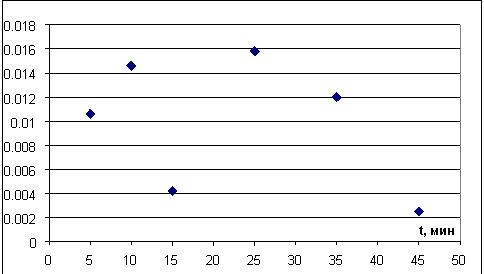
Рис. 14. График зависимости скорости изменения массы кристалла от суммарного времени нагрева
По графикам на рисунках 12–14 видно, что при первых трех нагревах кристалл «прогревается», постепенно идет увеличение скорости потери кристаллизационной воды, при дальнейшем нагреве скорость изменения массы кристалла падает с каждым следующим нагревом. Это может быть связано с тем, что с поверхности кристалла большая часть кристаллизационной воды испарилась, а на разрушение кристалла и «выход» воды из объема кристалла необходимо больше времени.
Рассчитаем процент потерянной воды в кристалле. Подсчёт этого значения происходит следующим образом:
1. Количество вещества (ν) по определению
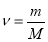
где m — масса кристалла (1.825г), M — молярная масса вещества: M (NiSO 4 ∙7H 2 O). Молярная масса вещества складывается из молярных масс компонентов, тогда
M (NiSO 4 ∙7H 2 O) = M (Ni) + M (S) + 4* M (O)+14* M (H)+7* M (O) =
= 58.7 + 32 + 4*16 + 14*1 + 7*16 = 280.7 г/моль.
Тогда количество вещества
ν = 1.825/280.7 = 0.006502 моль.
2. Далее, зная количество вещества, можем, согласно выражению (1), найти массы каждой из частей, входящих в состав кристалла. Умножаем количество вещества ν на молярную массу воды М (7H 2 O) и на молярную массу соединения М (NiSO 4 ), получаем:
m (7H 2 O) = 0.006502∙126 = 0.819202 г,
m (NiSO 4 ) = 0.006502∙154.7 = 1.005798г.
3. Выясним, сколько воды потерял кристалл в процессе эксперимента. Для этого из массы кристалла до нагрева (1.825г) вычтем массу кристалла после всех этапов нагрева (1.375г):
m (потерянной H 2 O) = 1.825–1.375 = 0.45 г.
Полученную разницу масс делим на значение массы воды в кристалле в начале эксперимента m (7H 2 O) в кристалле и получаем процент потерянной воды:
n = m (потерянной H 2 O)/ m (7H 2 O) = 0.45 г/0.819202 г ≈ 0.55 = 55 %
Обработка результатов последующих экспериментов проводилась по данному алгоритму. Результаты запишем в таблицу 3.
Таблица 3
Результаты расчета для потерь кристаллизационной воды.
|
m(до нагрева), г |
ν, моль |
m(после нагрева), г |
∆m, г |
m(NiSO 4 ) |
m(7H 2 O) |
потери воды, % |
|
1.825 |
0.006502 |
1.375 |
0.45 |
1.005798 |
0.819202 |
≈ 55 % |
- Результаты и выводы
Выполнено 11 экспериментов. В ходе проведения работы были получены следующие обобщенные результаты:
− научились работать с лабораторным оборудованием (электронные весы, плитка электронагревательная, контактный термометр, лабораторная посуда) и с химическими реактивами;
− вырастили кристаллы NiSO4∙7H2O методом охлаждения насыщенного водного раствора (получены как монокристаллы, так и сростки кристаллов);
− подтвердили на опыте, что при нагреве кристаллы NiSO4∙7H2O теряют кристаллизационную воду (что сопровождается изменением цвета и текстуры), определили процент потерянной воды в каждом эксперименте;
− научились обрабатывать результаты эксперимента.
На основе проведенных экспериментов можно сделать следующие выводы:
− потеря кристаллизационной воды проходит с поверхности кристалла (чем больше площадь поверхности кристалла, тем быстрее происходит потеря воды)
− наличие в кристалле трещин (или их образование в процессе нагрева) увеличивает скорость потери кристаллизационной воды за счет увеличения площади поверхности кристалла;
− чем выше температура кристалла, тем быстрее потеря воды;
− процент потерянной кристаллизационной воды в конце эксперимента связан с размером кристалла (чем крупнее осколки кристалла, тем меньших потерь воды удается добиться).
Существует множество нюансов, которые значительно влияют на результаты данных экспериментов:
− температура среды;
− время, которое отдаётся на остывание кристалла (во время остывания кристалл способен потерять некоторое количество воды);
− поверхность кристалла, где замеряется температура (если температуру мерить на высоте от плиты, она будет ниже, а проводя измерения ближе к плите или в толще кристалла, температура соответственно будет выше);
− свойства конкретного кристалла до эксперимента (размер, площадь поверхности и пр.).
Литература:
- Кристаллография: Лабораторный практикум/ Под ред. проф. Е. В. Чупрунова; Москва.: 2005.-412с.
- Кристаллография и кристаллохимия: учебник/ под редакцией академика В. С. Урусова; Москва.: 2014.-588с.
- Егоров-Тисменко Ю. К./ Руководство к практическим занятиям по кристаллографии — Москва.: 2010.-208с.
- Фаддеев М. А./ Элементарная обработка результатов эксперимента — Нижний Новгород: Издательство Нижегородского госуниверитета, 2004.-120с.
- Соболева Л. В./Выращивание новых функциональных монокристаллов — Москва.: ФИЗМАТЛИТ,2009–248с.
- Реми Г. / Курс неорганической химии Том I — Москва: Мир,1963–922с. ил.
- ru.crystalls/info/Сульфат_ никеля
- www.mincryst.ru.

















