Бессмертные раковые клетки и замкнутый круг жизни медуз Turritopsis nutricula, многовековые устои сообщества Голых Землекопов, удлинение теломер и перепрограммирование клеток — все это поможет изучить механизмы старения различных организмов и их потенциал к бессмертию. Автор предлагает читателю ознакомиться с теоретическими и практическими путями продления жизни на примере одноклеточных и многоклеточных формах жизни, с учетом последних научных открытий в биологии, генетике и медицине.
Ключевые слова: клетка, SENS, продление жизни, долголетие, биологическое бессмертие.
На протяжении всей истории человечества люди задумывались о вечной жизни. Понятие бессмертия всегда носило религиозный характер. Бессмертием наделялись боги и некоторые сказочные герои. Но в разные века в разных религиях и странах существовали мифы и легенды, утверждающие, что люди также могут получить от богов дар бессмертия. Однако достичь вечную жизнь предлагалось по-разному: разозлить богов или испить амброзии в Греции; принять ртуть или съесть персики бессмертия в Китае; выпить амриту в Индии; отведать золотые молодильные яблоки в Скандинавии; испить из святого Грааля в религии христианства (рис. 1).
![Бессмертие в мифологии разных народов: a) Боги Древней Греции [1]; b) Боги Древнего Египта [2]; c) Эликсир жизни (бессмертия) [3]; d) Боги Древней Руси [4]](https://moluch.ru/young/blmcbn/2855/2855.001.jpg)
Рис. 1. Бессмертие в мифологии разных народов: a) Боги Древней Греции [1]; b) Боги Древнего Египта [2]; c) Эликсир жизни (бессмертия) [3]; d) Боги Древней Руси [4]
В современном мире тема продления жизни человека стала рассматриваться чисто с научной стороны.
В физической форме, биологическое бессмертие одноклеточных организмов — это отсутствие индивидуальной смерти. Биологическое бессмертие сложноорганизованных многоклеточных живых существ, в том числе человека, может характеризоваться бесконечным онтогенезом или его циклами. Бессмертие человека — это жизнь в физической и духовной форме, не прекращающаяся неопределённо долгое время.
Степени бессмертия
В течении последних двух столетий возникло несколько теорий о потенциальном «бессмертии» прокариот и их устойчивости к старению. Дело в том, что результатом деления одноклеточных, в том числе безъядерных организмов, является пара дочерних клеток одного возраста. Они в свою очередь также раздвоятся при следующем делении. Покажем это на примере абстрактной прокариотической клетки, которую назовем Ми́мо.
Мимо делится, делится и снова делится, раздавая потомкам свои гены. Каждая новая клетка, по сути, является той же Мимо, но только другого возраста. Если же Мимо погибнет под влиянием неблагоприятных условий (ведь ее запросто могут съесть, она может умереть в холоде или при недостатке пищи), то её потомок, её клон с тем же геномом, продолжит существование, являясь той же Мимо. Другими словами, бессмертной является популяция прокариотов, но не индивидуальная клетка. В этом и заключается суть бессмертия прокариотов.
С одноклеточными эукариотами все намного сложнее. Их разнообразие огромно и, в каждом отдельном случае существуют свои закономерности и исключения.
Например, в культуре клетки эукариот живут ограниченное время. Это обусловлено тем, что на концах молекулы ДНК есть специальные структуры — теломеры (рис. 2), защищающие хромосомы от деградации, а также определяющие возраст клетки. Считается, что теломеры не несут генную информацию. Во время деления теломеры постепенно укорачиваются и, достигнув предела Хейфлика, клетка перестаёт делиться [5]. Если бы этого не происходило, то при дальнейшем делении клетка стала бы терять концевые участки ДНК с важной информацией, что привело бы к возникновению генетических мутаций.
![Теломеры [6]](https://moluch.ru/young/blmcbn/2855/2855.002.png)
Рис. 2. Теломеры [6]
Исключением являются раковые клетки, каждая из которых может делиться бесконечно. Самыми известными «бессмертниками» являются клетки рака шейки матки HeLa. Они были взяты у Генриетты Лакс доктором Дж. Хопкинсом в 1951 г., незадолго до ее смерти [7]. Оказалось, что эти клетки размножались гораздо быстрее клеток из нормальных тканей. Кроме того, злокачественная трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений. In vitro такого прежде не происходило ни с какими другими клетками. Высокое воспроизводство и выносливость клеток сделали возможным разводить их в лабораториях по всему миру. Клетки HeLa стали первой «шаблонной» клеточной линией [7].
Наряду с раковыми клетками, относительно бессмертными являются стволовые клетки. Стволовые клетки — неспециализированные клетки, которые могут делиться неограниченное число раз и в подходящих условиях дифференцироваться в специализированные клетки одного и более типов. Эмбрионы ранних стадий многих животных содержат так называемые плюрипотентные стволовые клетки, т. е. клетки, способные порождать дифференцированные клетки любого типа. В теле взрослых организмов также имеются стволовые клетки, которые по мере необходимости служат для замены «устаревших» специализированных клеток. В отличие от эмбриональных стволовых клеток, стволовые клетки взрослых организмов не способны превращаться в любые клетки в организме, лишь в несколько определенных типов. Исследование эмбриональных или взрослых стволовых клеток является источником ценных сведений о дифференциации и имеет огромный потенциал для применения в медицине. Конечной целью является получение клеток для восстановления поврежденных или больных органов [8].
В настоящее время эмбриональные стволовые клетки (ЭС-клетки) получают из эмбрионов, пожертвованных пациентами, или из долгосрочных клеточных культур, изначально выделенных из донорских эмбрионов. Но этот способ до сих пор вызывает множество этических и политических споров. Теперь эти споры стали менее актуальными, потому что ученые научились программировать полностью дифференцированные клетки, возвращая их до состояния ЭС-клеток. Такие «перепрограммированные» клетки известны как индуцированные плюрипотентные стволовые клетки (иПС-клетки). По многим критериям иПС-клектки могут выполнять большинство функций ЭС-клеток, но есть некоторые различия в экспрессии генов и других клеточных функциях.
На данный момент существует несколько основных потенциальных применений иПС-клеток. Во-первых, они могут выступать в качестве моделей для изучения заболеваний пациентов, у которых были взяты клетки. Во-вторых, для замены нефункциональных тканей.
Замкнутый круг
Но почерпнуть знания о продлении жизни можно не только на клеточном уровне. К примеру, пресноводная Гидра (рис. 3) уже не одну сотню лет служит ученым всего мира, как объект исследований.
![Пресноводная гидра [9]](https://moluch.ru/young/blmcbn/2855/2855.003.png)
Рис. 3. Пресноводная гидра [9]
Ещё в конце XIX века появилось предположение о биологическом бессмертии гидры, которое пытались научно доказать или опровергнуть на протяжении всего XX века. Однако только в 1997 году гипотеза была доказана экспериментальным путём Даниэлем Мартинесом [10]. После перехода к половому размножению гидры погибают. Это говорит о наличии у гидр механизмов старения, возникающих после гаметогенеза. Но после бесполого размножения гидры продолжают жить. Считается, что «бессмертность» гидр напрямую связана с их высокой регенерационной способностью.
В 1996 году был раскрыт удивительный секрет медуз класса Сцифоидные, рода Turritopsis, (рис. 4), который очень быстро стал мировой научной сенсацией [11]. Океанолог и специалист по медузам Фердинандо Боеро случайно допустил высыхание воды в своем аквариуме с медузами. Эта оплошность повернула жизненный цикл Сцифоидных вспять. Взрослые особи превратились в младенцев-личинок. Через какое-то время личинки стали полипами, от которых позже отпочковались новые медузы, идентичные предыдущим.
![Медуза Turritopsis [12]](https://moluch.ru/young/blmcbn/2855/2855.004.png)
Рис. 4. Медуза Turritopsis [12]
Это первый известный случай, когда многоклеточные животные были способны полностью вернуться в «детство» после достижения половой зрелости. Исходя из того, что в экспериментах Боеро, подтвержденных другими исследованиями, все Turritopsis периодически трансформировались, то есть из состояния медузы переходили в стадию полипа, следует предположить, что естественная смерть в жизненном цикле организмов этого вида не происходит.
Медузы и гидры являются прекрасными объектами для изучения механизмов бессмертия и регенерации. Они хранят в себе еще очень много тайн, которые ученым предстоит разгадать. Важно отметить, что чем сложнее строение и организация живого существа, тем реже встречаются явления регенерации и «возрождения».
Жители подземного царства
Среди млекопитающих также есть чрезвычайно важные для исследования продления жизни и геронтологии существа. Одним из таких существ является Голый землекоп (Heterocephalus glaber) (рис. 5), относящийся к отряду грызунов. Эти голенькие, непрезентабельные и немного страшненькие зверьки хоть и не смогли обмануть смерть, но избежали старость. При размере всего лишь 10 см и массе 30 г Голые землекопы живут 30 лет и более, тогда как другие грызуны такого же размера живут около 3 или 4 лет.
![Голый землекоп [13]](https://moluch.ru/young/blmcbn/2855/2855.005.jpg)
Рис. 5. Голый землекоп [13]
До недавнего времени было известно только то, что клетки голых землекопов не подвержены репликативному старению [14]. Отсутствие шерсти, небольшие, по сравнению с другими грызунами, размеры, позднее половое созревание, а также активное образование новых нейронов в головном мозге позволяют говорить о неотении [15]. Даже внешне взрослые Голые землекопы похожи на новорожденных грызунов. Они не дряхлеют, не страдают деменцией, атеросклерозом и диабетом. Погибают землекопы или от стычек с врагом, или от остановки сердца, выработавшего ресурс. Как и у других маленьких грызунов, в клетках землекопов работает теломераза — фермент, достраивающий теломеры. Но секвенирование их генома показало, что в генах, кодирующих их теломеразу и связанные с ней белки, есть существенные отличия от аналогичных генов других грызунов.
Итак, что же отличает африканских землекопов-долгожителей от всех остальных млекопитающих [16]:
– Особенности структуры и мощный конститутивный синтез глобинов позволяют землекопам эффективнее снабжать мозг кислородом;
– Низкая биологическая активность инсулина (из-за радикальных изменений β-цепи) и утилизация глюкозы альтернативным путем. У голого землекопа уровень гликированного гемоглобина в течение жизни стабилен, диабет не встречается;
– Инактивация гена FASTK может частично защищать от рака, воспаления и клеточного старения;
– Уникальный процессинг 28S рРНК Голого землекопа, вероятно, вносит вклад в высокую точность трансляции и потрясающую стабильность протеома;
– Среди генов, подвергавшихся действию положительного отбора у землекопа по сравнению с крысами и мышами, обнаружены TEP1 и TERF1, участвующие в регуляции длины теломер, а, следовательно, в репликативном старении клеток.
Можно предположить, что если бы Homo sapiens старел эквивалентно землекопу, то биологический возраст 80-летнего человека не превышал бы 30 лет, а средняя продолжительность жизни такого человека была бы около 240 лет.
Тайны вечной жизни человека
Homo sapiens — вид особенный. Мы отличаемся от всех остальных млекопитающих как биологически, так и социально.
В настоящее время ученые рассматривают несколько потенциальных путей достижения существенного продления жизни: генная инженерия, клонирование, а также трансплантация и протезирование органов.
Можно выделить несколько механизмов старения человека:
– Нестабильность генома;
– Клеточное старение;
– Укорочение теломер;
– Эпигенетические альтерации;
– Нарушение протеостаза;
– Уменьшение количества стволовых клеток;
– Изменение межклеточного взаимодействия.
Самая известная комплексная научно-исследовательская программа для устранения всех типов возрастных повреждений носит название «Стратегии достижения пренебрежимого старения инженерными методами», а если коротко — SENS (англ. Strategies for Engineered Negligible Senescence) [17, 18]. Она специализируется в области сохранения и восстановления клеток и тканей человеческого тела. Цель SENS — создание системы периодического устранения ущерба, который наносят здоровью человека возрастные изменения.
Генная инженерия
Причины старения клеток млекопитающих и в том числе человека до сих пор плохо изучены. Обычно выделяют как минимум четыре независимых процесса старения клеток [14]:
1) Репликативное старение (replicative senescence);
2) Стресс-индуцированное старение (SIPS, stress-induced premature senescence);
3) Онкоген-индуцированное старение (oncogene-induced senescence);
4) Запрограммированное старение (developmental senescence).
Значительные разногласия вращаются вокруг того, существует ли очевидный генетический механизм, который служит биологическими часами, определяющими темп разрушения организма.
В неделящейся человеческой (и не только) клетке со временем накапливаются токсичные белки, слабеют митохондрии, начинает давать сбои регулировка активности генов и включаются механизмы апоптоза.
Как уже было сказано ранее, теломеры защищают хромосомы, а соответственно и генетический материал клетки. Длину теломер поддерживает фермент теломераза (рис. 6). Теломераза наиболее активна в эмбриональных клетках, т. е. эти клетки обладают неограниченным потенциалом деления. В стволовых клетках активность теломеразы ниже, что позволяет лишь частично компенсировать укорачивание теломер. В соматических клетках активность теломеразы обычно отсутствует.
![Структура теломер [19]](https://moluch.ru/young/blmcbn/2855/2855.006.png)
Рис. 6. Структура теломер [19]
Ученые смогли создать «иммортализованные» клетки. Это клетки, взятые из нормальной ткани, но получившие «суперспособность» к неограниченному числу делений. Однако эти клетки обладают рядом недостатков: нестабильность генома, потеря физиологических функций, а также серьезная угроза возникновения злокачественных опухолей.
Передача сигналов Wnt/β-катенина является критическим регулятором стволовых клеток, а нарушение регуляции пути связано с раком. В эмбриональных стволовых клетках β-катенин был способен напрямую регулировать экспрессию и активность теломеразы [20].
Эксперименты на мышах показывают, что с увеличением активности теломеразы в теломерах растет продолжительность жизни мышей, при этом не увеличивается частота опухолевых заболеваний. Применить это на человеке и других крупных организмах — сложно. Считается, что укорочение теломер и последующая гибель «человеческой» клетки являются предохранительным механизмом от злокачественного перерождения [15].
В настоящее время проводятся огромное количество фундаментальных исследований в области генетики и цитогеронтологии. Однако, о практическом применении результатов этих исследований, а тем более о создании препаратов против старения говорить пока рано.
Клонирование
Клонирование — это один из методов биотехнологии, применяемый для получения идентичных потомков различных организмов при помощи бесполого размножения. Если говорить другими словами, то клонирование является процессом создания идентичных копий организма или клетки. При этом клон может повторять не только генотип своего «родителя», но и его фенотип.
На рисунке 8 и последующей за ним таблице 1 показаны этапы развития этой области биотехнологии.
Взгляд в прошлое
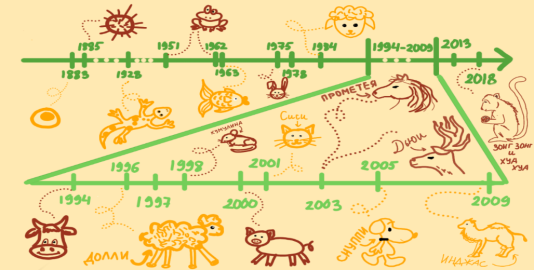
Рис. 8. Развитие клонирования
Таблица 1
История клонирования
|
Дата |
Название события |
Дата |
Название события |
|
1883 |
Открыта яйцеклетка немецким цитологом О. Гертвигом. |
1996 |
Ян Уильмут клонировал овцу. 5 июля 1996 года на свет появилась клонированная овечка дорсетской породы, которую назвали Долли. |
|
1885 |
Х. Дриш разделил двухклеточный эмбрион морского ежа и получил двух идентичных близнецов. |
1997 |
В английском журнале Nature была опубликована сенсационная статья группы сотрудников Рослинского института об успешном клонировании овечки Долли. |
|
1928 |
Х. Шпеман клонировал саламандру с помощью пересадки ядра из одной клетки в другую. |
1998 |
В Университете штата Гавайи международная группа ученых клонировала 50 мышей из клеток взрослых особей. Первая мышь-клон получила прозвище Кумулина. |
|
1951 |
Р. Бриггс и Т. Клинг, используя методы Шпемана по эмбриональному переносу ядра, успешно клонировали лягушек |
2000 |
Английские ученые провели первую успешную операцию по клонированию свиней. |
|
1962 |
Дж. Гердон успешно клонировал и «вырастил» Южно-Африканских лягушек. |
2001 |
В Техасском университете агрокультуры и машиностроения родилась первая в мире клонированная домашняя кошка по кличке Сиси. |
|
1963 |
Британский биолог Джон Холдейн впервые употребил термин «клон». Китайский исследователь Т. Динчжоу впервые клонировал рыбу (карпа). |
2003 |
в Техасском университете агрокультуры и машиностроения родились первый клонированный олень — Дьюи и первая клонированная лошадь — Прометея. Усыпление Долли. |
|
1975 |
Английский биолог Д. Браунхолл впервые клонировал кролика. |
2005 |
В Южной Корее на свет появилась первая в мире клонированная собака — африканская борзая Снуппи. |
|
1978 |
Рождение первого ребенка от суррогатной матери. |
2009 |
В Дубае (ОАЭ) родился первый клонированный верблюд — Инджас. |
|
1984 |
Датский ученый С. Вилладсен клонировал овцу из эмбриональных клеток, первый эксперимент по клонированию млекопитающего. |
2013 |
Получены стволовые клетки из клонированного эмбриона. |
|
1994 |
Н. Ферст успешно провел клонирование эмбриона теленка. |
2018 |
Китайские ученые впервые клонировали и вырастили двух клонов длиннохвостых макак — Зонг Зонг и Хуа Хуа. |
Если, например, клонировать человека, то получится генетически идентичный ему эмбрион. Донор как будто родится заново. Теоретически этот процесс перерождения можно будет продолжать бесконечно. Каждый раз будет рождаться молодая копия старого организма. Тем не менее, даже при развитии в одной среде, клонированные организмы не могут быть полностью идентичными, так как всегда существуют индивидуальные отклонения в развитии (отпечатки пальцев, сетчатка глаза).
Наше «Я» — это в значительной мере наша память. Весь жизненный опыт, навыки, эмоции — все это, хранится в памяти. Создавая клона, мы получаем только внешнюю копию индивида, предоставляя ей пользоваться нашей внешностью и жить своей жизнью.
Клонирование человека неоднозначно оценивается как научной, так и широкой общественностью. С одной стороны оно открывает путь к освобождению от генетических заболеваний и продлению жизни, но с другой, наука еще не в состоянии определить последствия, к которым оно может привести. Клонирование человека запрещено Конвенцией о защите прав и достоинств человека в связи с применением достижений биологии и медицины, принятой в 1997 году.
Трансплантация и протезирование органов
Наш организм можно рассматривать как сложную биологическую машину, состоящую из различных биоматериалов, с приводом и системой управления. У Homo sapiens есть базовая конструкция, проверенная тысячелетиями, а узлы и детали этой конструкции, как и в любом механизме, имеют свойство выходить из строя. Если сравнивать наше тело с машиной, износившиеся части можно заменять новыми. Так можно было бы поступить со всеми больными, травмированными и просто старыми органами.
На данный момент наука и технологии предлагают нам несколько способов замены «вышедших из строя» органов:
– Бионические (механические) протезы [21];
– Искусственные органы и тканевая инженерия [22, 23];
– Трансплантаты [24].
Несмотря на то, что каждый из этих методов может существенно продлить жизнь человеку [23], достичь бессмертия в «своем» теле навряд ли получится. В том числе, неизбежно возникает много этических и юридических вопросов, связанных с идентификацией личности.
Более того, в настоящее время во многих странах на законодательном уровне запрещена трансплантация головы и мозга, в том числе в Российской Федерации [25].
Заключение
Бессмертие может быть великой целью, и в его поисках совершаются значимые открытия. Тем не менее, перед наукой стоит еще много нерешенных задач.
Старость и смерть — основа эволюции и прогресса всего живого. С этой позиции общество закостенелых Кощеев и консервативных Землекопов-долгожителей, возможно, не совсем то, к чему стоит стремиться. Но старость и смерть не должны быть преждевременными.
Илья Мечников писал, что для изменения человеческой природы, прежде всего надо отдать себе отчет в идеале, к которому следует стремиться, и затем употребить все средства, представляемые наукой для его достижения [26]. Биологическое и физической бессмертие осуществимо только для вида в целом. Бессмертие же индивида возможно только в его творениях.
Литература:
- Четыре факта об античных богах. — Текст: электронный // Yandex.Zen: [cайт]. — URL: https://zen.yandex.ru
- Бальдр Прекрасный: миф об умирающем боге. — Текст: электронный // Yandex.Zen [cайт]. — URL: https://zen.yandex.ru
- Рецепты долголетия: 5 секретов со всего мира. — Текст: электронный // Ramayoga [cайт]. — https://Ramayoga.ru
- Кому мешает Язычество и как его выдавливают из современного общества. — Текст: электронный // vk [cайт]. — https://vk.com
- Шаронов Г. 12 методов в картинках: клеточные технологии / Г. Шаронов. — Текст: электронный // Биомолекула: [сайт]. — URL: https://biomolecula.ru/articles/metody-v-kartinkakh-kletochnye-tekhnologii#source-1 (дата обращения: 14.03.2022)
- Мы всего лишь боремся со смертью, а вы? Или компании, которые развивают фантастическую медицину. — Текст: электронный // Хабр [cайт]. — URL: https://Habr.com
- Старокадомская А. Бессмертные клетки HeLa / А. Старокадомская. — Текст: электронный // Элементы.ру: [сайт]. — URL: https://elementy.ru/nauchno-populyarnaya_biblioteka/432536/Bessmertnye_kletki_HeLa (дата обращения: 14.03.2022)
- Mahla RS (2016). «Stem Cells Applications in Regenerative Medicine and Disease Therapeutics». International Journal of Cell Biology. 2016 (7): 1–24. doi:10.1155/2016/6940283. PMC 4969512. PMID 27516776
- URL: https://cdn.britannica.com/84/95884–050–59B92081/version-one.jpg
- Martinez D. E. (1998). Mortality patterns suggest lack of senescence in hydra. Experimental Gerontology. 33(3), 217–225
- Piraino S., Boero F., Aedchbach B., Schmid V. Reversing the Life Cycle: Medusae Transforming into Polyps and Cell Transdifferentiation in Turritopsis nutricula (Cnidaria, Hydrozoa). Reference //Biol. Bull. 1996. Vol.190, June. P. 302–312
- Бессмертные животные, которые переживут всех нас. — Текст: электронный // Кот-пёс: [cайт]. — URL: https://kot-pes.com
- Голый землекоп: описание, фото, образ жизни удивительного зверька. — Текст: электронный // Дон Черепах: [cайт]. — URL: https://cherepah.ru
- Лосева П. Клетки голых землекопов стареют не так, как клетки мышей / П. Лосева. — Текст: электронный // Элементы.ру: [сайт]. — URL:https://elementy.ru/novosti_nauki/433211/Kletki_golykh_zemlekopov_stareyut_ne_tak_kak_kletki_myshey (дата обращения: 14.03.2022)
- Тюменцев М. Лекарства от старения, и где они обитают / М. Тюменцев. — Текст: непосредственный // Наука из первых рук. — 2018. — № 1. — С. 40–50
- Волкова О. Преодолевшие старение. Часть II. Дети подземелья / О. Волкова. — Текст: электронный // Биомолекула: [сайт]. — URL: https://biomolecula.ru/articles/preodolevshie-starenie-chast-ii-deti-podzemelia (дата обращения: 14.03.2022)
- URL: https://www.sens.org
- Strategies for Engineered Negligible Senescence. — Текст: электронный // Википедия: [cайт]. — URL: https://ru.wikipedia.org
- Рубцова М. П., Василькова Д. П., Малявко А. Н., Нарайкина Ю. В., Зверева М. Э., Донцова О. А. (2012) Функции теломеразы: удлинение теломер и не только Acta Naturae (русскоязычная версия)
- K. Hoffmeyer, A. Raggioli, S. Rudloff, R. Anton, A. Hierholzer, et. al. (2012). Wnt/β -Catenin Signaling Regulates Telomerase in Stem Cells and Cancer Cells. Science. 336, 1549–1554
- Петренко А. Киборги среди нас / А. Петренко. — Текст: электронный // Биомолекула: [сайт]. — URL: https://biomolecula.ru/articles/kiborgi-sredi-nas (дата обращения: 14.03.2022)
- Кондратенко Ю. Органы из лаборатории / Ю. Кондратенко. — Текст: электронный // Биомолекула: [сайт]. — URL: https://biomolecula.ru/articles/organy-iz-laboratorii (дата обращения: 14.03.2022)
- Пешкова А. Тканевая инженерия — окно в современную медицину / А. Пешкова. — Текст: электронный // Биомолекула: [сайт]. — URL: https://biomolecula.ru/articles/tkanevaia-inzheneriia-okno-v-sovremennuiu-meditsinu (дата обращения: 14.03.2022)
- Трансплантация органов. — Текст: электронный // Википедия: [cайт]. — URL: https://ru.wikipedia.org
- Федорова Г. Ю. (2017). Правовое регулирование трансплантации головы в Российской Федерации / Г. Ю. Федорова // Молодой ученый. — № 36 (170). — С.64–66
- Мечников И. И. Этюды о природе человека. / И. И. Мечников. — Москва: Издательство Академии наук СССР, 1961. — 290 с.












