В статье рассмотрены различные способы получения хромата аммония, а также раскрыты его химические свойства.
Ключевые слова: неорганическое соединение, химические свойства, хромат аммония.
Получению и свойствам хромата аммония посвящен ряд публикаций [1–6], что указывает на определенный интерес исследователей к этой проблеме. Для меня эта тема является важной, актуальной и представляет интерес потому, что она не изучается в школе на уроках химии.
Известно, что существует несколько способов получения неорганического соединения с формулой (NH 4 ) 2 CrO 4 в лаборатории и промышленности [5–7]:
1. Растворение оксида хрома (VI) в растворе аммиака:
CrO 3 + 2NH 3 · H 2 O → (NH 4 ) 2 CrO 4 + H 2 O.
2. Взаимодействие раствора дихромата аммония с концентрированным раствором карбоната аммония при кипении:
(NH 4 ) 2 Cr 2 O 7 + (NH 4 ) 2 CO 3 (конц.) → 2(NH 4 ) 2 CrO 4 + CO 2 ↑.
3. Взаимодействии дихромата аммония с раствором аммиака:
(NH 4 ) 2 Cr 2 O 7 + 2NH3 · H 2 O → 2(NH 4 ) 2 CrO 4 + H 2 O.
Рассмотрим получение препарата реактивной чистоты взаимодействием дихромата аммония с раствором аммиака. Для этого в колбу емкостью 100 мл наливаем 25 мл воды. Нагреваем колбу с водой до 70–75 °С и растворяем в ней 15 г дихромата аммония ((NH 4 ) 2 Cr 2 O 7 ) при постоянном перемешивании.
Когда вещество растворилось, очень осторожно при перемешивании добавляем 20 %-ный раствор аммиака NH 4 OH до перехода оранжевой окраски в желтую (рис. 1). После этого раствор охлаждаем до температуры +5 °С. Образовавшиеся кристаллы отсасываем на воронке Бюхнера, промываем и сушим (под тягой), перемешивая при комнатной температуре. Масса хромата аммония составила 14, 47 г (≈ 80 %).

Рис. 1. Хромат аммония
При повышении кислотности раствора или добавлении триоксида хрома CrO 3 хромат аммония переходит в дихромат, трихромат и т. д.:
2CrO 4 2- + 2H + → Cr 2 O 7 2- + H 2 O;
(NH 4 ) 2 CrO 4 + CrO 3 → (NH 4 ) 2 Cr 2 O 7 .
Хромат аммония вступает:
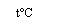
(NH 4 ) 2 CrO 4 + 2NaOH → Na 2 CrO 4 + 2NH 3 ↑ + 2H 2 O;
в реакции ионного обмена [8]:
(NH 4 ) 2 CrO 4 + 2AgNO 3 → Ag 2 CrO 4 ↓ + 2NH 4 NO 3 ;
красно-оранжевый
(NH 4 ) 2 CrO 4 + Ba(NO 3 ) 2 → BaCrO 4 ↓ + 2NH 4 NO 3 ;
желтый
(NH 4 ) 2 CrO 4 + NiSO 4 → NiCrO 4 ↓ + (NH 4 ) 2 SO 4 .
черный
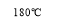
2(NH 4 ) 2 CrO 4 → Cr 2 O 3 + 2NH 3 ↑ + N 2 ↑ + 5H 2 O.
При длительном хранении на воздухе постепенно теряет аммиак и превращается в дихромат аммония [5]:
2(NH 4 ) 2 CrO 4 → (NH 4 ) 2 Cr 2 O 7 + 2NH 3 ↑ + H 2 O.
Проявляет сильные окислительные свойства [3]. В кислой среде восстанавливается до Cr 3+ , в нейтральной — до Cr(OH) 3 , в щелочной — до [Cr(OH) 6 ] 3- :
2(NH 4 ) 2 CrO 4 + 3SO 2 + 2H 2 SO 4 → 2(NH 4 ) 2 SO 4 + Cr 2 (SO 4 ) 3 + 2H 2 O.
4(NH 4 ) 2 CrO 4 + 3C 2 H 5 OH + 10H 2 SO 4 → 3CH 3 COOH + 2Cr 2 (SO 4 ) 3 + 4(NH 4 ) 2 SO 4 + 13H 2 O.
Для доказательства окислительных свойств хромата аммония [7] возьмем несколько кристаллов этого вещества и поместим их в пробирку. Добавим 2–3 капли концентрированной серной кислоты. К полученной смеси дольем несколько капель этилового спирта. При интенсивном встряхивании наблюдаем изменение окраски раствора c жёлтой на зелёную.
Хромат аммония легко образует двойные хроматы, например, с раствором нитрата никеля [9]:
2(NH 4 ) 2 CrO 4 + Ni(NO 3 ) 2 + 6H 2 O → (NH 4 ) 2 Ni(CrO 4 ) 2 · 6H 2 O + 2NH 4 NO 3 .
Реагирует с концентрированной серной кислотой [10]:
(NH 4 ) 2 CrO 4 + H 2 SO 4 (конц.) → CrO 3 + (NH 4 ) 2 SO 4 + H 2 O.
Полученные результаты исследований могут быть использованы при изучении соответствующих учебных тем на факультативах и кружках в школе.
Литература:
- Разница между хроматом и дихроматом [Электронный ресурс]. — Режим доступа: https://raznisa.ru/raznica-mezhdu-hromatom-i-dihromatom/ (дата обращения 14.03.2022).
- Реакция термического разложения хромата аммония [Электронный ресурс]. — Режим доступа: https://chemiday.com/reaction/3–1-0–7786 (дата обращения 13.03.2022).
- Ступакова, С. В., Козлова, М. А. Получение дихромат аммония в реакции обмена и изучение его химических свойств / Наука молодых — будущее России: сборник научных статей 3-й Международной научной конференции перспективных разработок молодых ученых: в 6 т. — Курск, 2018. — С. 274–277.
- Талышева, А.А., Деева, М. И. Исследование соединений хрома [Электронный ресурс]. — Режим доступа: https://school-science.ru/5/13/34580 (дата обращения 12.03.2022).
- Хромат аммония [Электронный ресурс]. — Режим доступа: https://chem.ru/hromat-ammonija.html (дата обращения 12.03.2022).
- Аммоний хромовокислый (аммоний хромат) [Электронный ресурс]. — Режим доступа: http://c-books.narod.ru/karyakin1_NH4_2CrO4.html (дата обращения 27.03.2022).
- Гельфман, М. И., Юстратов, В. П.: Неорганическая химия: учебное пособие. — 2-е изд., стер. — СПб.: Издательство «Лань», 2009. — 528 с.
- Получение хромата аммония [Электронный ресурс]. — Режим доступа: https://mybiblioteka.su/3–13665.html? (дата обращения 27.03.2022).
- Неорганическая химия: в 3 т. / под ред. Ю. Д. Третьякова. Т. 3: Химия переходных элементов. Кн. 1: учебник / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов. — М.: Издательский центр «Академия», 2007. — 352 с.
- Гаршин, А. П. Общая и неорганическая химия в схемах, рисунках, таблицах, химических реакциях: учебное пособие. — СПб.: Питер, 2013. — 288 с.











