В статье уделяется внимание одному из стехиометрических законов в химии: закон эквивалента.
Ключевые слова: эквивалент, объемные соотношения, простое вещество, кислота, основание, соль, оксид.
Одним из разделов химии являются стехиометрические законы: сохранения массы, постоянства состава, кратных отношений, объемных отношений и эквивалентов.
В 18-м веке, ещё до создания атомно-молекулярной теории, было установлено, что все простые и сложные вещества вступают в химические реакции в строго определённых массовых отношениях друг к другу.
Так, например, в молекулах H 2 O, HCl и NaH с 1,008 массовой единицей водорода соединяются соответственно 8 массовых единиц кислорода, 35,5 массовых единиц хлора и 23 массовых единиц натрия. (Массовой единицей может быть грамм, килограмм, тонна, миллиграмм, пуд и т. д.) Таким образом, эти массовые количества кислорода, хлора и натрия эквивалентны (равноценны) между собой.
Эквивалентом элемента называется количество его массовых единиц, которое соединяется с 1,008 массовой единицей водорода или 8 массовыми единицами кислорода, или замещает эти количества в соединениях. Из этого определения следует, что эквивалент кислорода равен 8, а эквивалент водорода 1,008 (в задачах можно брать 1).
Между эквивалентом, атомной массой и валентностью элемента существует зависимость:
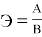
По этой формуле определяют теоретическое значение эквивалента элемента, т. е. простого вещества.
Например, чтобы определить эквивалент простого вещества кальция нужно по периодической системе Д. И. Менделеева определить атомную массу кальцию, которая равна 40 и определить валентность кальция, она равна 2. Подставляем данные значения в формулу.
Э Са
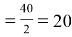
Понятие эквивалента применимо не только к химическому элементу, но и к химическим соединениям: под эквивалентом соединения понимают такое количество его массовых единиц, которое в данной реакции взаимодействует с одним эквивалентом водорода, или с одним эквивалентом кислорода, или с одним эквивалентом любого другого вещества.
Грамм-эквивалент (г-экв) — это количество вещества, масса которого, выраженная в граммах, численно равна эквиваленту этого вещества.
Например, эквивалент магния равен 12, а грамм-эквивалент магния — 12 г.
Как для элементов, так и для сложных веществ имеет место закон эквивалентов: “вещества вступают в реакции между собой в отношении их эквивалентов”. Поэтому важно знать, как вычисляются эквиваленты сложных веществ. Вот несколько правил.
Чтобы определить эквивалент кислоты , используют формулу:
Э
кислоты
=
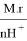
молекулярную массу кислоты делят на основность (число ионов Н + ).
Например, чтобы определить эквивалент серной кислоты H 2 SO 4 первым действием необходимо рассчитать молекулярную массу серной кислоты
M.r (H 2 SO 4 ) = 1 . 2 + 32 + 16 . 4 = 98
Вторым действие рассчитываем эквивалент серной кислоты, молекулярную массу 98 делим на основность кислоты, которая определяется по количеству водорода в кислоте, т. е. равна 2.
Э =
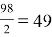
Рассмотрим второй пример, рассчитываем эквивалент ортофосфорной кислоты H 3 PO 4. Основность в данной кислоте равна трем, поэтому в данной формуле молекулярную массу ортофосфорной кислоты делим на три.
M.r (H 3 PO 4 ) = 1 . 3 + 31 + 16 . 4 = 98
Э =
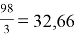
Чтобы определить эквивалент основания используют формулу:
Э
основания
=
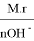
молекулярную массу основания делят на число групп ОН.
Например, чтобы определить эквивалент гидроксида кальция Ca(OH) 2 первым действие рассчитываем молекулярную массу гидроксида кальция
M.r (Ca(OH) 2 ) = 40+ 16 . 2 + 1 . 2 = 74
Вторым действие рассчитываем эквивалент гидроксида кальция, молекулярную массу 74 делим на количество группы ОН, которая равна 2.
Э =
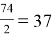
Чтобы определить эквивалент соли используют формулу:
Э
соли
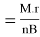
Эквивалент солей находят путем деления молекулярной массы соли на суммарный заряд катионов металла, входящего в состав молекулы соли. Например, чтобы определить эквивалент соли сульфата алюминия первым действием рассчитываем молекулярную массу соли Al 2 (SO 4 ) 3.
M.r (Al 2 (SO 4 ) 3 ) = 27 . 2+ 32 . 3 + 16 . 4 . 3 = 342
Вторым действием рассчитываем эквивалент соли, молекулярную массу 342 делим на 6 (в состав этой соли входят катионы Al 3+, заряд каждого катиона 3, число катионов в одной молекуле 2, суммарный заряд катионов получается равным 6).
Э
соли
=
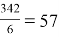
Чтобы определить эквивалент оксида используют формулу:
Э
оксида
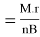
где n-количество элемента, В — валентность элемента.
Например, чтобы определить эквивалент оксида хрома (III) первым действием рассчитываем молекулярную массу оксида Cr 2 O 3
M.r (Cr 2 O 3 ) = 52 . 2+ 16 . 3 = 152
Вторым действие рассчитываем эквивалент оксида хрома (III), молекулярную массу 152 делим на произведение количества катиона хрома, которая равна 2 и валентность хрома, которая равна 3.
ЭCr
2
O
3
=
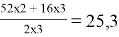
При вычислении эквивалента вещества, участвующего в конкретной реакции, необходимо учитывать конкретный состав продуктов реакции.
Например: а) H 2 SO 4 + NaOH = NaHSO 4 + H 2 O
В этой реакции от каждой молекулы кислоты участвует только один ион водорода, поэтому эквивалент H 2 SO 4 численно равен молекулярной массе, т. е. 98.
б) KAl(SO 4 ) 2 + 3KOH = Al(OH) 3 + 2K 2 SO 4
От KAl(SO 4 ) 2 в обменной реакции участвует только алюминий, поэтому эквивалент KAl(SO 4 ) 2 равен 358/3 = 86.
в) Сr(OH) 3 + HNO 3 = Cr(OH)(NO 3 ) 2 + 2H 2 O
Чтобы найти эквивалент Сr(OH) 3 в этой реакции, надо молекулярную массу этого вещества разделить на число замещенных на кислотный остаток групп OH - . В нашем примере замещается две группы OH -, а одна входит в состав образующейся основной соли. Тогда эквивалент Сr(OH) 3 равен 103: 2 = 51.5.
Эквиваленты, в отличие от атомной или молекулярной массы, не являются постоянной величиной. Если элементы образуют между собой несколько соединений, то величины эквивалентов будут различными. Так, эквиваленты азота в соединениях N 2 O, NO, N 2 O 3 , NO 2 , N 2 O 5 имеют соответственно значения 14; 7; 4,67; 3,5; 2,8.
Формулировка закона эквивалента
Закон эквивалента (1800г) был открыт ученым В.Рихтер: Массы веществ реакции прямо пропорциональны их эквивалентам:
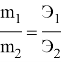
При расчетах с использованием закона эквивалентов нам не нужно уравнение реакции и не важно, какой именно активный металл использовался. Нужно знать, сколько молей эквивалентов задействовано в реакции и какова молярная масса эквивалента получаемого металла.
Пример: на восстановление 66,07 г оксида двухвалентного металла требуется 24 г. алюминия. Вычислите эквивалентную массу оксида.
Решение: согласно закону эквивалентов:
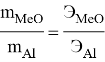
Эквивалент алюминия определяем по формуле эквивалент простого вещества:
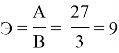
Подставляем все значения в формулу закона эквивалента:
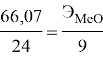
Э
MeO
=
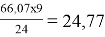
В заключение данной статьи очевидно, что практика и занятия помогут быстрее закрепить тему эквивалента и научиться решать задачи.
Литература:
- Головнева, И. И. Основные понятия в химии Красноярский государственный аграрный университет, 2005
- В. С. Аксенов Закон эквивалентов и его применение в химических расчетах — Юго-Западный государственный университет, 2010









