В статье анализируются способы опреснения морской воды, практическое применение методов опреснения в домашних условиях с выявлением оптимального метода.
Согласно исследованиям, множество людей страдают от нехватки воды: 780 миллионов людей не имеют доступ к чистой питьевой воде, а 1,7 млрд нуждаются в пресной воде.
Вода покрывает 70 % нашей планеты, и многие думают, что ее всем хватит. Однако уже сегодня пресной воды остро не хватает. Только 3 % от всех водных ресурсов Земли — пресная вода, и две трети ее спрятаны в замерзших ледниках или недоступны для использования.
Причины дефицита пресной воды:
1. Урбанизация и индустриализация. Воду загрязняют пестициды и удобрения с ферм, неочищенные сточные воды и промышленные отходы. Они попадают даже в подземные воды, в результате вода становится непригодной для питья. Стремительная урбанизация требует значительных инвестиций в инфраструктуру очистки сточных вод. Многие города не могут себе этого позволить, и объемы неконтролируемых промышленных отходов и неочищенных сточных вод растут.
2. Сельское хозяйство. Расточительное использование воды приводит к пересыханию рек, озер и даже подземных источников. Кроме того, сельское хозяйство загрязняет воду удобрениями и пестицидами. Сельское хозяйство использует 70 % доступной в мире пресной воды, но около 60 % ее расходуется впустую из-за негерметичных ирригационных систем, а также из-за выращивания культур, которые поглощают очень много водных ресурсов.
3. Рост населения. Буквально в ноябре 2020 году на Земле уровень населения вырос до 8 миллиардов людей. 7 миллиардов было в 2011 году. Следовательно, будет необходимо производить и выращивать больше еды и продовольствия. Хотя уже сейчас более 40 % населения планеты, живет в местах, где наблюдается тот или иной дефицит ресурсов. Основной рост населения сейчас наблюдается в развивающихся странах, которые уже страдают от нехватки воды. И, следовательно, проблема дефицита пресной и питьевой воды будет одной из главных в обозримом будущем.
В отличие от ледников и других источников пресной воды, морская вода является самой доступной. Например, можно построить опреснительную станцию на берегу моря, без дальних экспедиций к ледникам, дорогостоящих транспортировок и бурения скважин.
Умение опреснять воду самостоятельно могло бы решить данную проблему.
Объект исследования : морская вода.
Проблема : как опреснить морскую воду в домашних условиях.
Предмет : способ опреснения морской воды.
Цель работы : научиться опреснять воду различными способами и выбрать наиболее оптимальный.
Задачи :
1.Изучить вопрос актуальности темы.
2.Изучить способы опреснения воды.
3.Провести эксперименты.
4.Выявить оптимальный способ опреснения воды.
Гипотеза : можно получить пресную воду из морской воды.
Актуальность выбранной темы :
- Сейчас есть страны, в которых очень мало пресных водоёмов, и они активно опресняют воду.
- В связи с ростом населения планеты необходимость в пресной воде постоянно растёт.
- Развитие производства и технологический прогресс увеличивают потребности в воде.
- В будущем уменье опреснять воду или знать, как это делать, может стать необходимым знанием для человека.
- Если мы окажемся на необитаемом острове, окружённом океаном (или морем) без запасов воды (или если они закончатся), то мы сможем добыть воду путём опреснения.
Методы исследования : анализ литературы, источников информации в интернете, эксперимент, сравнение результатов эксперимента.
1. Теоретическое исследование
1.1 Описание объекта исследования с научной точки зрения
Основным источником питьевой воды является природная вода, которую очищают и обеззараживают муниципальные службы, осуществив все этапы водоподготовки и водоочистки, необходимые для получения сначала технической, а после водопроводной воды. В России основными являются водохранилища, реки, озера. Доля подземных вод не велика.
Источники пресной воды можно разделить на: дождевая и талая вода, подземные источники (колодцы, артезианские скважины, родники и т. д.), водозабор из водохранилищ, рек, озёр и т. п., опреснители, вода из айсбергов.
1.2 Физические свойства питьевой воды
Питьевая вода должна быть такой, чтобы через слой ее в 30 см можно было прочесть печатный шрифт определенного размера.
Вода должна быть бесцветной. Наличие окраса у воды может говорить о проблемах с водопроводом. После очистки воды на водопроводных станциях цветность ее уменьшается. При лабораторных исследованиях сравнивают интенсивность цветности питьевой воды с условной шкалой стандартных растворов и результат выражают в градусах цветности. В водопроводной воде цветность не должна превышать 20°.
Причиной запаха и привкуса питьевой воды может быть загрязнение и промышленными сточными водами. Привкус и запахи некоторых подземных вод объясняются наличием большого количества растворенных в них минеральных солей и газов, например, хлоридов, сероводорода. При обработке воды на водопроводных станциях интенсивность запаха уменьшается, но незначительно.
1.3 Химический состав питьевой воды
Вода содержит в себе множество растворенных элементов: железо, соли кальция и магния, хлориды, сульфаты, фтористые соединения.
Железо находится в подземных водах, при контакте воды с воздухом железо окисляется, образуя гидроксид железа, придающий воде мутность и бурую окраску. При содержании в воде подземных источников железа в концентрации более 0,3–0,5 мл/л органолептические свойства воды ухудшаются, а при концентрации железа свыше 1–2 мг/л вода, кроме мутности и окраски, приобретает неприятный вяжущий привкус. Содержание железа в водопроводной воде не должно превышать 0,3 мг/л, а в воде местных источников водоснабжения — 1 мг/л.
Жесткость воды: соли кальция и магния . Наличие солей кальция и магния обусловливает жесткость воды (моль/л). Воду с жесткостью до 1,75 моль/л, считают мягкой, от 1,75 до 3,5 — средней жесткости, от 3,5 до 7 — жесткой, выше 7 моль/л — очень жесткой. С увеличением жесткости воды ухудшается разваривание мяса и бобовых, увеличивается расход мыла, усиливается образование накипи в паровых котлах и радиаторах, приводящее к излишнему расходу топлива и необходимости частой очистки котлов. В соответствии с требованиями стандарта жесткость питьевой воды не должна превышать 3,5 моль/л (7 мг-экв/л).
Хлориды (хлор-ион). Обычно в проточных водоемах содержание хлоридов невелико (до 20–30 мг/л), но может значительно возрастать в водоемах, не имеющих стока. Незагрязненные колодезные воды в местах с не солонцеватой почвой обычно содержат до 30–50 мг/л хлоридов. Воды, фильтрующиеся через солонцеватую почву или осадочные породы, богатые соединениями хлора, могут содержать сотни и даже тысячи мг/л хлоридов, будучи безукоризненными в другом отношении. Воды, содержащие хлориды в количестве, превышающем 350–500 мг/л, имеют солоноватый привкус и неблагоприятно влияют на желудочную секрецию. Поэтому по ГОСТу 2874–82 содержание хлоридов в водопроводной воде не должно превышать 350 мг/л.
Сульфаты (сульфатион). Сульфаты в количестве, превышающем 500 мг/л, придают воде горько-соленый вкус, неблагоприятно влияют на желудочную секрецию и могут вызвать диспепсические явления (особенно при одновременно большом содержании магния в воде) у людей, не адаптированных к употреблению воды подобного состава.
Фтористые соединения вымываются водой из почвы и горных пород. Ион фтора, входящий в эти соединения в небольших количествах, способствует развитию и минерализации костей и зубов. При прочих равных условиях заболеваемость населения кариесом зубов снижается с повышением концентрации фтора в воде до 1 мг/л. Однако при содержании в воде больше 1,5 мг/л фтора возникает другое заболевание зубов — флюороз. На эмали зубов появляются мелоподобные или пигментированные (желтого или коричневого цвета) пятна. В тяжелых случаях возможно разрушение эмали. Оптимальным содержанием фтора в питьевой воде считают 0,7–1,0 мг/л.
Токсичные вещества. Присутствие в воде токсичных веществ связано главным образом со сбросом в водоем промышленных сточных вод. В этих случаях ознакомление с технологией производства позволяет решить вопрос, какими исследованиями необходимо дополнить обычный анализ воды. В воду могут попадать также смываемые осадками с сельскохозяйственных полей устойчивые к разложению пестициды.
1.4 Способы опреснения воды
Электродиализ . В ванну с рассолом устанавливают 2 электрода в виде электрохимических активных диафрагм (с пластмассовым или резиновым корпусом и наполнителем из смол), после чего пропускают постоянный ток. Проходит химическая реакция с выделением в атмосферу хлора и кислорода. Вода скапливается в промежуточных камерах и отводится, а соляной раствор остается в емкости.
Ультрафильтрация (обратный осмос). Такой метод еще называют ионообменное опреснение: он применяется там, где соленость морской воды изначально невысока. Также он часто используется для мобильных установок на рыболовецких судах, траулерах. В этом случае солевой раствор подают под давлением через мембрану, которая проницаема для воды, но непроницаема для соли. Такие мембраны создают из ацетилцеллюлозного волокна и пропитывают перхлоратом магния, что позволяет увеличить водопроницаемость. Поскольку давление значительное, до 150 кгс/см2, мембраны дополняются пористыми бронзовыми плитами. Управление процессом возможно в автоматическом и полуавтоматическом режиме, при этом главное здесь — контроль стабильного давления подачи воды. Выход пресной воды из соленой — до 70 %.
Термическое опреснение (дистилляция). Такой метод часто используют на морских судах для получения пресной воды из забортной соленой. В этом случае морскую воду нагревают до кипения, а выходящий пар конденсируют. Так собирается дистиллят, представляющий собой пресную воду. Дистилляционные установки включают в себя испарители, нагревательные элементы, конденсаторы и сборники дистиллята. Сам процесс испарения может быть, как одно-, так и многоступенчатым. При этом из первичного пара получается до 90 % пресной воды за одну ступень. В установках с многоступенчатым опреснением, когда не вскипевшая вода перетекает из одной камеры в другую, и так до 5060 раз, выход воды увеличивается в 15–20 раз. Однако такие системы гораздо сложнее в работе из-за существенной концентрации солевого раствора на последних этапах и порчи оборудования из-за отложения солей на трубопроводах.
1.5 Технологии, активно используемые в странах лидерах по опреснению.
Лидером в этой отрасли считается Израиль, где расположены крупнейшие заводы по опреснению, обеспечивающие более 15 % потребности в питьевой воде, и более 50 % — в технической. Один из самых крупных местных заводов производит забор воды из Средиземного моря и фильтрует ее посредством специальных мембран. Дальше осуществляется перегонка, после чего чистая вода поступает в хранилища, а соляной раствор сбрасывается в море.
Французские заводы используют несколько другие способы опреснения воды: большинство установок работают на принципе обратного осмоса. Популярной в промышленных масштабах стоит назвать и технологию выпаривания.
2. Экспериментальные исследования
2.1 Описание места и условий проведения исследований
С детства мы знаем правило: “Морскую воду пить нельзя”. Оно приводится во всех инструкциях по выживанию, например, для летчиков и моряков, терпящих бедствие на море. Но, может быть, в крайних случаях и по чуть-чуть все-таки можно?
Морская вода имеет среднюю соленость около 35 грамм на литр. Почкам, чтобы вывести из организма соли, содержащиеся в 100 г воды, требуется 160 г воды. То есть, чем человек будет больше пить, тем больше ему воды нужно. Очень скоро наступит обезвоживание организма, и человек погибнет от интоксикации (отравления). Обезвоживание усугубляет то, что в морской воде среди прочих солей содержится сульфат магния, вызывающий расстройство желудка.
Чтобы очистить морскую воду используют опреснительные установки. Такие устройства есть на судах и в промышленности. Они очищают морскую воду от солей и делают ее пригодной для питья. Простейшую опреснительную установку можно сделать своими руками.
2.2 Описание способа определения степени очищения воды.
Для проверки качества очищения воды в домашних условиях лучше всего подойдут тест полоски и специальные приборы.
В качестве полосок были выбраны следующие:

Инструкция по использованию: необходимо опустить тест-полоску для анализа качества воды в исследуемый образец, вынуть и подождать 30–60 секунд. Затем сверить цвет полоски с индикаторной шкалой и интерпретировать результат. Тестирование осуществляется по 16 элементам: -кислотность pH(ph),-общая щелочность;-нитраты;-нитриты;-общий хлор;-остаточный свободный хлор;-жесткость;-ртуть;-медь;-бром;-хром;-винец;-железо;-фторид;-карбонаты;-циануровая кислота
В качестве прибора выбрали: Тестер качества воды Xiaomi (рисунок 2):
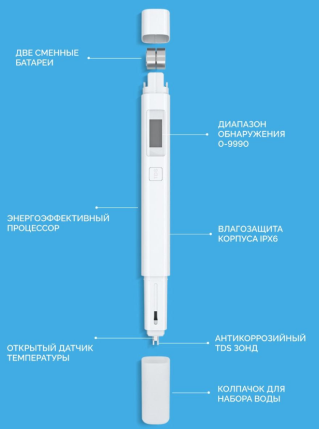
При помощи него можно измерять уровень минеральных солей, органических веществ и нерастворимых крупных веществ. Тестер считывает все значения и показывает, насколько пригодна вода. Значение 30 и ниже говорит об очень хорошем качестве воды, от 30 до 170 пригодная для питья, если показатели выше стоит воздержаться от употребления такой воды.
2.3 Опыт 1. Опреснение на солнце
Для изготовления опреснителя понадобится: полиэтиленовый пакет, большая широкая емкость (лучше тазик, но у нас была только кастрюля), маленькая емкость для сбора воды (например, кружка).
Конструкция самодельного опреснителя проста. В большую емкость, на дно которой поставлена кружку, наливаем морскую воду так, чтобы ее уровень был ниже высоты кружки. Сверху большую емкость герметично затягиваем пакетом. После этого на пакет кладем небольшой камешек, чтобы он провисал над кружкой. Ставим конструкцию в солнечное место и ждем. Нагреваясь, вода в большой ёмкости начинает испаряться и конденсироваться на “крыше” из пакета. Когда капли станут достаточно крупными, то они начнут стекать по наклону и капать в чашку. Это будет чистая пресная вода — ведь испаряется именно она, а все соли и прочие загрязнения остаются в емкости.



В результате испарения воды в емкости диаметром 20 см в течение восьми часов (с 9 до 17 часов) получилось 19 мл пресной воды на 100 мл. Если бы мы взяли емкость большего диаметра — ведро или тазик, воды выпарилось бы больше. Проба воды на вкус: очень пресная.


2.4 Опыт 2. Испарение воды в замкнутой системе на солнце.
Соединить горлышки 2-х пластиковых бутылок с помощью изоленты. В темную бутылку наливаем морскую воду, примерно на третью часть объема. Поместить конструкцию под солнечные лучи. Темная бутылка должна располагаться ниже, чтобы обеспечить проход пара во вторую бутылку, но не вертикально.



В ходе эксперимента нам удалось добыть 13 мл пресной воды на 100 мл морской воды. Полученная вода также, как и по результатам предыдущего опыта получилась пресная.


2.5 Опыт 3. Опреснение воды при помощи кипячения.
Во время проведения опыта на море, к сожалению, под рукой не оказалось ТДС датчика и тест полосок, чтобы определить пригодность этой воды для питья. Поэтому решили повторить эксперимент с выпариванием в домашних условиях, так как в обоих случаях принцип воздействия на воду сохраняется. Необходимы компоненты: пластиковая бутылка 1,5 л, морская вода, электрический или газовый чайник, емкость для сбора воды, тестер.
Наливаем морскую воду в чайник. Наденем на носик чайника специальный колпак с трубкой. По этой трубке пар будет выходить из чайника. Сделаем две дырки в бутылке и пропустим через них шланг. Бутылку наполним водой. Она будет служить охлаждением для пара. Во время охлаждения он будет конденсироваться в воду. Второй конец шланга опускаем в ёмкость для сбора воды. Начнём кипятить воду.


В результате мы получим небольшое количество конденсированной воды. В результате получилось 34 мл воды на 100 мл. По показателям тестера вода практически дистиллированная.



2.6 Опыт 4. Опреснение бытовым фильтром.
Необходимые компоненты: бытовой фильтр, морская вода, тест-полоски качества воды, TDS-тестер. Пропускаем морскую воду через бытовой фильтр. Оцениванием замер тест-полосками и TDS-тестером.


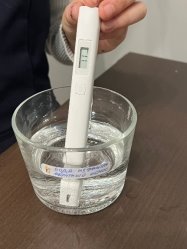
В результате получилась такая же соленная вода. Пусть и немного очищенная от всяких примесей. Всего получилось 86 мл воды на 100 мл изначального объема.






2.7 Опыт 5. Опреснение воды при помощи заморозки. Вариант 1
Необходимы компоненты: пластиковая бутылочка 0,5 л, морская вода, морозильник. Наливаем морскую воду в емкость. Отправляем жидкость в морозильник. Когда жидкость полностью замерзнет, перенесем емкость в теплое место. Через некоторое время снимем верхний слой подтаявшего льда, а оставшейся части воды дадим полностью растаять. Измерим данные после разморозки ТДС прибором.
Соленая вода замерзает медленнее пресной. Когда температура снижается ниже нуля, образуются кристаллы пресного льда, а соль выталкивается в жидкость. При нагревании именно соленые участки первыми размораживаются. Кристаллы пресного льда тают долго. Сняв подтаявший верхний слой соленой воды, добились того, что в емкости осталась пресная вода. Измерили данные ТДС прибором, который показал значения не пригодные для питья 6760 ppm. Получилось 76 мл воды пресной, но не пригодной для питья воды на 100 мл воды начального объема.



2.8 Опыт 6. Опреснение воды при помощи заморозки. Вариант 2
На основе проведенного опыта с размораживанием мы решили повторить опыт, но сливать соленую воду постепенно. Этот опыт покажет нам насколько снижается уровень солей каждый раз при сливании верхнего слоя.
Необходимы компоненты: пластиковая бутылка 0,5 л, морская вода, морозильник, емкость для сбора воды., тестер. Наливаем в емкость 0,5 л морской воды и замораживаем. Вынимаем из морозилки и размораживаем. Каждые полчаса сливаем размороженную воду (примерно 50 мл) и делаем замер тестером.
Показания тестера при последовательной разморозке морской воды:
Таблица 1
|
Номер разморозки |
1–5 |
6 |
73 |
8 |
9 |
10 |
|
Показания тестера |
Выше возможности тестера |
7020 |
6850 |
4180 |
3390 |
1140 |
Замеры первых пяти размороженных проб без показания. Содержимое соли большое. Датчик зашкаливает. Далее каждая размороженная проба показывала значение качества воды лучше предыдущей. Последняя проба по качеству не получилась питьевой, значение 1140 ppm.
Самый затратный по времени способ получения питьевой воды. Исходя из данных, приведенных в Таблице 1 можно сказать, что для получения пригодной для питья воды, необходимо разморозить около пяти литров морской воды. Для этого нам необходимо постепенно размораживать и сливать воду порядка ста раз каждые пол часа. Весь процесс займет около пятидесяти часов, а предполагаемый объем полученной воды будет равен пятидесяти миллилитрам.
2.9 Сравнение результатов экспериментов.
Внесём информацию о каждом опыте в таблицу. Будем оценивать можно ли пить воду. Сравнение потребительских качеств полученной воды:
Таблица 2
|
Наименование опыта Параметр |
Опыт1. Опр-е на солнце |
Опыт 2. Испарение воды в замкнутой системе на солнце. |
Опыт 3. Опр-е воды при помощи кипячения |
Опыт 4. Опр-е быт. фильтром. |
Опыт 5. Опр-е воды методом заморозки. |
Опыт 6. Заморозка 2. |
|
Можно ли пить? |
да |
да |
да |
нет |
нет |
да |
|
Количество полученной воды на 100 мл |
19 |
13 |
34 |
86 |
14.4 |
5 (50 мл при разморозке 5 л |
|
Время |
7ч. |
7ч. |
5 мин. |
2 мин. |
5 ч. |
50 ч. |
Запишем в таблицу показания замеров разных источников воды и способов очистки. Показания тестера замеров воды из разных источников:
Таблица 3
|
Источник воды |
Вода из-под крана |
Вода водопроводная фильтрованная фильтр-кувшином |
Вода водопроводная очищенная фильтром обратного осмоса |
Морская вода |
|
Значение |
173 |
143 |
11 |
выше предела замера |
Таблица 4
Замеры показания тестера после фильтрации/очистки морской воды
|
Способ фильтрации/очистки морской воды |
После фильтра угольного (кувшин) |
Незамёрзший остаток |
Вода после заморозки |
Вода после заморозки Опыт 2 |
Испарение |
|
Значение |
231 |
выше предела замера |
6760 |
1140 |
22 |
Показания замеров тест-полосками отфильтрованной, очищенной воды:

Морская вода оказалась сильно щелочной и жесткой, как и вода из-под крана. Фильтр кувшин помогает справится с излишней щелочью в воде, но не делает ее питьевой. Тест-полоски подтвердили данные ТДС прибора, о том, что вода не пригодна для питья.
По результатам тест-полосок, можно сказать, что размораживание и выпаривание очищают морскую воду лучше, чем фильтр-кувшин. Удалось добиться уменьшения жесткости и щелочности воды. Однако, данные ТДС прибора говорят о том, что вода не пригодна для питья.
Показания тест-полоски анализа воды после опреснения:


2.10 Описание места и условий проведения исследований.
Опыты 1,2 и 3 проводились во время летних каникул на море. Все остальные опыты проводились в домашних условиях при нормальной комнатной температуре. Морская вода во всех опытах была из одного моря (чёрного).
2.11 Выводы.
После проведения опытов мы можем сделать следующие выводы: научились опреснять воду различными способами и выбрали наиболее подходящий для применения в домашних условиях. Провели эксперименты по фильтрации морской воды, по опреснению морской воды. Выполнили замеры качества полученной воды с помощью тест-полосок и тестера. Проанализировав результаты пришли к выводу, что наиболее пригодная для питья вода получилась в третьем опыте — выпаривание кипячением. А в условиях, приближенным к экстремальным — во втором.
Таким образом, наша гипотеза подтвердилась: мы получили пресную воду из морской как в домашних, так и в приближенных к экстремальным условиям. Принцип работы опреснителя строится на базовых физических процессах. Можно, используя знания и смекалку, соорудить из подручных средств опреснитель, с помощью которого можно получить питьевую воду методом замораживания или нагрева.
Заключение :
– Выяснили причины дефицита пресной воды;
– Изучили физические свойства питьевой воды;
– Изучили промышленные способы опреснения воды;
– Научились использовать приборы оценки качества воды;
– Научились получать пресную воду.
Литература:
- Танганов Б. Б., Морская вода и проблема ее опреснения, Современные наукоемкие технологии. 2010г., № 7, стр. 90–92.
- Слесаренко В. Н., Опреснение морской воды, Издательство «Энергоатомиздат», 1991г.
- Ветштейн В., Опреснение морской воды и здоровье человека, http://samlib.ru/e/etkin_w/opresnenijevodyizdorovxe.shtml
- Кирпичникова И. М., Опреснение воды с использованием энергий ветра и солнца, Вестник южно-уральского государственного университета. Серия: Энергетика. 2012г., № 16, стр. 22–25.
- Волович В. Г., Человек в экстремальных условиях природной среды, М.: Мысль, 1980г.











