В данной статье микробиота рассматривается как отдельный орган человека. Изучены способы ее коррекции с целью улучшения качества и продолжительности жизни и нормализации функций организма.
Ключевые слова: кишечная микробиота, микрофлора, желудочно-кишечный тракт, заболевание, микроорганизм, функция, нарушения, неонатальная микробиота.
В настоящее время микробы можно найти практически в каждой нише человеческого организма. Однако сложность микробиоты данного участка зависит от конкретных условий окружающей среды. Преобладать будут только микробы, способные расти в этих условиях. Микроорганизмы не только оказывают влияние на физиологические процессы организма человека, такие как послеродовое развитие, иммуномодуляция и энергоснабжение, но также влияют на развитие нервной системы, поведения и когнитивных способностей [1].
Что такое микробиота?
Микробиота человека представляет собой эволюционно сложившуюся экологическую систему разнообразных микроорганизмов, населяющих открытые полости организма и поддерживающих биохимическое, метаболическое, иммунологическое равновесие, необходимое для сохранения здоровья[4]. Совокупность всех микроорганизмов человека составляет от 3 до 5 % от общего веса, это больше, чем мозг или сердце. Было подсчитано, что микроорганизмы составляют до 100 триллионов клеток, что в десятки раз превышает число наших собственных клеток. Также было предположено, что они кодируют в 100 раз больше уникальных генов, чем наш собственный геном [2]. Микробиота каждого человека имеет свой неповторимый состав и развивается на протяжении всей жизни.
Установлено пять мест в нашем теле (биотопов), где концентрация микроорганизмов максимальная: желудочно-кишечный тракт, кожа, дыхательные пути, полость рта, мочеполовая система. При этом большая их часть сосредоточена в кишечнике, который представляет собой как бы отдельный орган [3].
Микробиота кишечника и её функции
Бактерии, составляющие микробиологическую среду в желудочно-кишечном тракте (ЖКТ), связанные закономерностями межвидовых взаимодействий внутри экологической ниши, называются кишечной микробиотой [6].
Микробиота кишечника представляет собой метаболически активную биомассу весом до 2 кг. В кишечнике, особенно в толстой кишке, присутствует очень многочисленное и разнообразное микробное сообщество, количество видов которого, по имеющимся данным, колеблется от 400 до 1500 [5].
Здоровье человека и даже его настроение зависят от микробиоты. Нормальная микробиота кишечника защищает хозяина от инфекции, снижает провоспалительный ответ, морфологически связана с иммунной системой клеток кишечника, что минимизирует риск развития таких состояний, как аллергия или воспалительные заболевания кишечника. Микробы способны синтезировать вещества, обладающие успокаивающим эффектом. Они близки по формуле к феназепаму. Также есть бактерии, которые ответственны за выносливость, быстрое восстановление и психологическую устойчивость. Как показали наблюдения, в процессе физической нагрузки становится больше бактерии, умеющих перерабатывать молочную кислоту, углеводы и клетчатку, что помогает преодолевать возрастающие нагрузки.
Бактерии кишечника, производящие индолы (появляются в результате распада аминокислоты триптофан), определяют активность в пожилом возрасте и приостанавливают старение.
Микроорганизмы кишечника — основа его структурного и функционального существования. Нормальная микробиота у взрослых, будучи сугубо индивидуальной, имеет значительную степень стабильности и стремится к восстановлению после любых дисбиотических нарушений [8].
Результаты метагеномных исследований генетического состава и метаболического профиля кишечной микробиоты свидетельствуют о том, что данный микробиоценоз представляет собой отдельный экстракорпоральный орган человеческого организма. И как любой орган он выполняет множество различных важных функций (функции представлены в таблице 1) [7].
Таблица 1
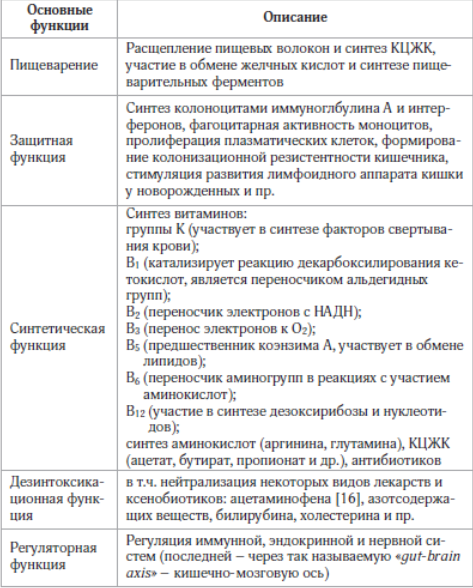
Нарушение микробиоты кишечника
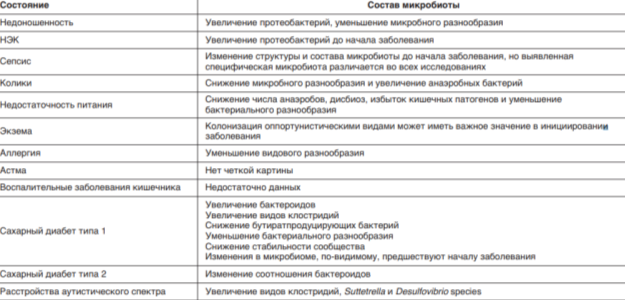
В настоящее время доказано, что нарушение состава кишечной микробиоты повышает риск или является непосредственной причиной развития инфекционных и неинфекционных заболеваний (таблица 2). Показано, что при избыточном бактериальном росте, повышении проницаемости слизистой кишечника, снижении иммунного статуса макроорганизма развиваются условия для бактериальной транслокации (проникновение бактерий из кишечного содержимого во внутреннюю среду организма), бактериемии (присутствие жизнеспособных микроорганизмов в крови) и сепсиса. С угнетением анаэробной флоры антибиотиками и активизацией условно-патогенных микробов связано развитие инфекционной антибиотико-ассоциированной диареи.
Имеются доказательства роли дисбиозной кишечной микрофлоры в формировании ожирения и сахарного диабета 2-го типа, а также атеросклероза и артериальной гипертензии. Нарушение состава и функции кишечной микробиоты ассоциируется с развитием воспалительных заболеваний кишечника и рака толстой кишки. Доказано, что нарушение состава кишечной микрофлоры может быть причиной атопических заболеваний (бронхиальная астма, атопический дерматит, аллергический ринит) [4].
Имеются доказательства связи дисбиоза кишечной микрофлоры с развитием нейродегенеративных заболеваний головногомозга. Взаимонаправленные связи между кишечником и мозгом осуществляются посредством эндокринной, нервной, иммунной систем и неспецифического природного иммунитета. Кишечная микрофлора как активный участник кишечномозговой оси не только оказывает влияние на кишечные функции, но также стимулирует развитие ЦНС в перинатальном периоде и взаимодействует с высшими нервными центрами, вызывая депрессию и когнитивные расстройства при патологии. Также осуществляется нейротрансмиттерная, иммунологическая, барьерная и моторная функции в кишечнике. Существует взаимосвязь между барьерной функцией кишечника и регуляцией гематоэнцефалического барьера. Хроническая эндотоксинемия как результат дисфункции кишечного барьера формирует устойчивое воспалительное состояние в околожелудочковых зонах мозга с последующей дестабилизацией гематоэнцефалического барьера и распространением воспаления на другие участки мозга, следствием чего является развитие нейродегенерации [20].
Таблица 2
Состав микробиоты при различных состояниях [19]
Неонатальная микробиота, ее нарушения
Наиболее чувствительна к воздействию неблагоприятных факторов неонатальная микробиота. Воздействие антибиотиков на «незрелую» микробиоту новорожденного ребенка приводит к снижению разнообразия состава кишечной микрофлоры, что делает ребенка более подверженным инфекционным и неинфекционным заболеваниям. Дети, получавшие антибиотики в раннем неонатальном периоде, имеют более высокий риск развития атопических заболеваний в течение первого года жизни, а также бронхиальной астмы, воспалительных заболеваний кишечника, ожирения в более позднем возрасте. Метаболиты кишечных микробов играют важнейшую роль в формировании и деятельности головного мозга и, таким образом, могут влиять на формирование когнитивных функций и поведение ребенка.
Исследования показали, что дети, рожденные путем кесарева сечения, подвержены большему риску развития астмы и атопии главным образом потому, что в составе их микробиоты кишечника имеет место более низкое содержание Bacteroidetes и низкое их видовое разнообразие. Следовательно, отсутствие разнообразия микробиоты в целом предшествует развитию аллергических проявлений.
По мнению многих ученых, внутриутробный и неонатальный периоды –критические этапы формирования микробиоты ребенка, от которых во многом зависит состояние его здоровья в течение всей жизни [9,10].
Факторы, влияющие на формирование микробиоты
Формирование кишечной микробиоты начинается при рождении, и новые бактерии появляются последовательно в течение первых лет жизни, пока не будет достигнута очень сложная микробиота взрослого типа. На кишечную микробиоту и ее формирование влияет широкий спектр факторов, включая здоровье матери, зрелость и доношенность ребенка, особенности родов, время первого кормления, характер вскармливания, состав питания, здоровье ребенка и характер его лечения в случае болезни, а также гигиенические особенности окружающей среды [11].
Дисбиоз и возможности коррекции микробиоты с целью улучшения качества и продолжительности жизни и нормализации функций организма
Дисбиоза — изменения в качественном и/или количественном составе микробиоты кишечника с развитием микробиологического дисбаланса между представителями ее микробной флоры.
Дисбиоз может развиваться под воздействием как эндогенных факторов, таких как генетическая предрасположенность, так и экзогенных воздействий, включая прием антибиотиков [12,13], лекарственных препаратов [14], психологического и физического стресса [15,16], радиации [17], патогенных микроорганизмов, и изменения диеты.
Изменения в структуре микробиоты при дисбиозе могу проявляться уменьшением бактериального разнообразия, увеличением количества патогенных микроорганизмов и нарушением функциональных свойств микробиоты.
Средствами коррекции кишечной микробиоты при дисбиозе являются:
— антибиотики
— пробиотики (живые микроорганизмы, использование которых в необходимом количестве оказывает лечебно-профилактическое воздействие на организм человека) [18];
— пребиотики — специальные ингредиенты немикробного состава, которые избирательно стимулируют рост и развитие нормальной микрофлоры кишечника (инулин, лактулоза) [19];
— синбиотики — продукты, представляющие собой комбинацию пробиотиков и пребиотиков, которые оказывают взаимноусиливающее воздействие на функции желудочно-кишечного тракта и обмен веществ в организме человека;
— трансплантация фекальной микробиоты (ТФМ) — введение фекальной суспензии, полученной от здорового человека, в ЖКТ другого человека с целью восстановления стабильной кишечной микробиоты [21].
Заключение
На протяжении всей жизни человека состав микробиоты динамически изменяется в зависимости от условий жизни и обеспечивает выполнение разнообразных и исключительно важных для человека функций. Не случайно с возрастом на фоне обеднения состава микробиоты начинают в полной мере проявляться атеросклероз, а также канцерогенез, чаще развиваются различные инфекции. Поэтому у учёных всё больше возникает интерес к детальному исследованию того, как микробиота может влиять на развитие патогенных состояний человека. Её дальнейшее исследование позволит точно и эффективно определять различные заболевания, а также разработать новые методы их лечения.
Литература:
- Schwiertz A, Rusch V. Microbiota of the Human Body Implications in Health and Disease. Advances in Experimental Medicine and Biology (eBook). 2016. https://doi.org/10.1007/978–3-319–31248–4
- https://www.nature.com/articles/nature08821#Sec1
- Marchesi J. R., Adams D. H., Fava F., Hermes Hirschfi eld G. M., Hold G. et al. Th e gut microbiota at health: A new clinical frontier. Gut. 2016; 65: 330–339 10.1136/gutjnl-2015–309990
- Николаева И. В., Царегородцев А. Д., Шайхиева Г. С. Формирование кишечной микробиоты ребенка и факторы, влияющие на этот процесс. Рос.вестник перинатол.и педиатрии. 2018; 63 (3): 13–16. Nikolaeva I. V., Tsaregorodtsev A. D., Shaikhieva G. S. Formation of the intestinal microbiota if children and the factors that infl uence this process. Ros Vestn Perinatol i Pediatr 2018; vol. 63, no. 3, pp. 13–18 (in Russ). DOI: 10.21508/1027–4065–2018–63–3–13–18
- https://link.springer.com/chapter/10.1007/978–3-319–31248–4_7
- http://gastro-rsmu.ru/wp-content/uploads/2017/06/mikrobiota.pdf
- https://www.rmj.ru/articles/gastroenterologiya/Kishechnaya_mikrobiota_sovremennye_predstavleniya_o_vidovom_sostave_funkciyah_i_metodah_issledovaniya/
- file:///C:/Users/KDFX %20Modes/Downloads/mikrobiota-cheloveka-kak-novaya-nauchnaya-paradigma-menyaet-meditsinskuyu-praktiku.pdf
- Miller W. B. The Eukaryotic Microbiome: Origins and Implications for Fetal and Neonatal Life. Front Pediatr 2016; 4: 96 DOI: 10.3389/fped.2016.00096
- Fox C., Eichelberger K. Maternal microbiome and pregnancy outcomes. Fertil Steril 2015; 104 (6): 1358–1363. DOI:10.1016/j.fertnstert. 2015.09.037
- https://www.lvrach.ru/2023/01/15438569
- Keeney KM, Yurist-Doutsch S, Arrieta MC, Finlay BB. Effects of antibiotics on human microbiota and subsequent disease. Annu Rev Microbiol. 2014;68:217–35. 35.
- Vangay P, Ward T, Gerber JS, Knights D. Antibiotics, pediatric dysbiosis, and disease. Cell Host Microbe. 2015;17(5):553–564.
- Syer SD, Wallace JL. Environmental and NSAID-enteropathy: dysbiosis as a common factor. Curr Gastroenterol Rep. 2014;16(3):377.
- Crvan IF, Dinan TG. Mind-altering microorganisms: the impact of the gi microbiota on brain and behaviour. Nat Rev Neurosci. 2012;13(10):701–712. 38.
- Collins SM. A role for the gut microbiota in IBS. Nat Rev Gastroenterol Hepatol. 2014;11(8):497- 505.
- Nam Y-D, Kim HJ, Seo J-G, Kang SW, Bae J-W. Impact of Pelvic Radiotherapy on Gut Microbiota of Gynecological Cancer Patients Revealed by Massive Pyrosequencing. PLoS ONE. 2013;8(12):e82659.
- Manipulation of the Microbiota Using Probiotics | SpringerLink https://link.springer.com/chapter/10.1007/978–3-319–31248–4_8
- Захарова И. Н., Лаврова Т. Е., Талызина М. Ф., Мачнева Е. Б. Новый взгляд на пребиотики: гипотезы, тенденции, доказательства. Педиатрия (Прил. к журн. Consilium Medicum). 2017; 3: 26–33. Zakharova I. N., Lavrov T. E., Talysina M. F., Machneva E. B. A new look at prebiotics: hypotheses, trends, evidence. Pediatrics (Suppl. Consilium Medicum). 2017, no. 3, pp. 26–33.
- Бондаренко В. М., Рябиченко Е. В. Кишечно-мозговая ось. Нейронные и иммуновоспалительные механизмы патологии мозга и кишечника. Журн. микробиол. 2013. № 2: 112–120. Bondarenko VM, Ryabichenko EV. Intestinal-brain axis. Neuronal and immune-infl ammatory mechanisms of brain and intestine pathology. Zh MikrobiolEpidemiolImmunobiol. 2013;(2):112–120. (In Russ).
- Карпухин О. Ю., Хасанов Э. Р., Бикбов Б. Ш. Трансплантация фекальной микробиоты в современной клинической практике https://cyberleninka.ru/article/n/transplantatsiya-fekalnoy-mikrobioty-v-sovremennoy-klinicheskoy-praktike/viewer










