Флуоресцеин — это очень интересное соединение. В наши дни он получил широкое распространение в самых разных областях применения: от индустрии красителей до медицины и научных исследований [1].
Целью работы являлось изучение возможностей применения флуоресцеина в разных сферах деятельности, а также разработка методики синтеза флуоресцеина, легко осуществимой в условиях школьной лаборатории.
- Флуоресценция как вид люминесценции.
Люминесце́нция — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения.
Впервые люминесценция была описана в XVII веке. Винченцо Каскариоло. Алхимик и сапожник из Болоньи, в 1603 г. нагрел смесь барита (сульфата бария) с углем. Порошок, полученный после охлаждения, ночью испускал голубоватое свечение, и Каскариоло заметил, что оно может быть восстановлено путем воздействия на порошок солнечного света. Одно из первых научных исследований люминесценции, проявляющейся при гниении древесины или плоти и в светлячках, было выполнено в 1672 году английским ученым Робертом Бойлем.
Природа люминесценции состоит в излучательных переходах электронов атомов или молекул из возбуждённого состояния в основное. При этом причиной первоначального их возбуждения могут служить различные факторы: внешнее излучение, температура, химические реакции и др. [2].
Многие формы природной люминесценции были известны людям очень давно. Например, свечение насекомых, свечение морских рыб и планктона, полярные сияния, свечение минералов и гниющего дерева. В настоящее время к природным формам прибавилось много искусственных способов возбуждения люминесценции. Твёрдые и жидкие вещества, способные люминесцировать, называют люминофорами.
Первоначально понятие «люминесценция» относилось только к видимому свету. В настоящее время оно применяется к излучению в инфракрасном, видимом, ультрафиолетовом и рентгеновском диапазонах.
Люминесцентное свечение тел делят на следующие виды:
Фотолюминесценция — свечение, возникающее под действием возбуждающего излучения в оптическом или ультрафиолетовом диапазоне длин волн;
Хемилюминесценция — свечение, использующее энергию химических реакций;
Катодолюминесценция — вызвана облучением быстрыми электронами (катодными лучами);
Сонолюминесценция — люминесценция, вызванная звуком высокой частоты;
Радиолюминесценция — при возбуждении вещества ионизирующим излучением;
Триболюминесценция — люминесценция, возникающая при растирании, раздавливании или раскалывании люминофоров. Триболюминесценция вызывается электрическими разрядами, происходящими между образовавшимися наэлектризованными частями — свет разряда вызывает фотолюминесценцию люминофора;
Биолюминесценция — способность живых организмов светиться, достигаемая самостоятельно или с помощью симбионтов;
Электролюминесценция — возникает при пропускании электрического тока через определённые типы люминофоров;
Кандолюминесценция — калильное свечение;
Термолюминесценция — люминесцентное свечение, возникающее в процессе нагревания вещества. В научной литературе часто используется термин термостимулированная люминесценция (ТСЛ) .
В настоящее время наиболее хорошо изучена фотолюминесценция, которая делится на:
—
флуоресценцию
(время жизни возбуждённого состояния
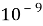
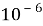
—
фосфоресценцию
(время жизни возбуждённого состояния
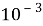
Фосфоресценция отличается от флуоресценции длительностью своего проявления. Для флуоресценции характерны сравнительно короткие характерные времена затухания порядка десятка наносекунд. У фосфоресценции времена затухания лежат в диапазоне от миллисекунд до секунд. Это объясняется разными видами перехода электронов с орбитали на орбиталь. Способные флуоресцировать атомы, молекулы и молекулярные комплексы называют флуорофорами, фосфоресцирующие соединения называют фосфорофорами соответственно.
Флуоресценция характеризуется рядом параметров, которые меняются в зависимости от физического окружения или химической модификации флуорофора. Флуоресценция всех флуорофоров имеет пять ключевых характеристик: спектры поглощения и флуоресценции, а также квантовый выход, время жизни и анизотропия флуоресценции [3].
Каждый флуорофор имеет индивидуальные спектры поглощения и флуоресценции . Для иллюстрации на рисунке 1 представлены спектры Lyso TrackerTM Blue (Molecular Probes®) и флуоресцеина. Основными параметрами спектров являются интенсивность флуоресценции, положение максимумов и так называемая полуширина (ширина спектра на уровне половины максимума). Часто именно эти параметры «информируют» об определенных свойствах окружения, в котором находится флуорофор. Так, в спектре флуоресценции многих флуорофоров возникают характерные изменения при разных рН среды [3].
![Спектры поглощения (пунктир) и флуоресценции (сплошные линии) флуоресцеина и Lyso TrackerTM Blue (Molecular Probes®) [3]](https://moluch.ru/young/blmcbn/4645/4645.004.png)
Рис. 1. Спектры поглощения (пунктир) и флуоресценции (сплошные линии) флуоресцеина и Lyso TrackerTM Blue (Molecular Probes®) [3]
На рисунке 2 в качестве примера показана рН-зависимость спектра флуоресценции Lyso SensorTM Yellow/Blue (Molecular Probes®).
![РН-зависимость спектра флуоресценции [3]](https://moluch.ru/young/blmcbn/4645/4645.005.png)
Рис. 2. РН-зависимость спектра флуоресценции [3]
Квантовый выход флуоресценции — это характеристика эффективности, с которой поглощенная энергия трансформируется в излучение по сравнению с процессами безызлучательной релаксации (процесса установления термодинамического, а следовательно, и статистического равновесия в физической системе, состоящей из большого числа частиц). Количественно квантовый выход определяется как отношение числа высвеченных фотонов к числу поглощенных. Чем больше квантовый выход, тем больше интенсивность свечения флуорофора. Квантовый выход флуоресценции может быть рассчитан по формуле:
Ф =
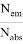
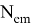
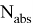
Время жизни флуоресценции — это усредненное время, в течение которого молекулы флоурофоров находятся в возбужденном состоянии перед испусканием фотонов флуоресценции. Измеряется этот показатель по затуханию флуоресценции после кратковременного возбуждения.
Анизотропия флуоресценции — это количественная характеристика зависимости поляризации флуоресценции от поляризации возбуждающего света [3]..
В 1933 году польским физиком Александром Яблонским была представлена диаграмма, отражающая разницу между механизмами фосфоресценции и флуоресценции. На диаграмме Яблонского показана разница в длине волн флуоресценции и фосфоресценции (см. рис. 3).
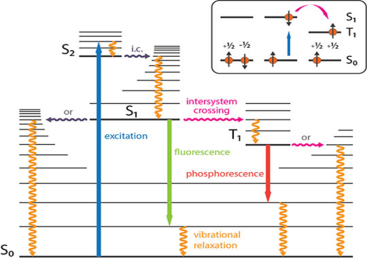
Рис. 3. Разница в длине излучаемых волн фосфоресценции и флуоресценции
Источник: https://www.enzo.com/note/what-is-the-difference-between-fluorescence-phosphorescence-and-luminescence/
Также для флуоресценции характерна реабсорбция (перепоглощение) — поглощение квантов люминесценции в толще самого образца. Это является причиной зелёного свечения раствора флуоресцеина при попадании на него света и розового свечения при выходе лучей света из него.
- Химические и физические свойства флуоресцеина.
Флуоресцеин
— это органическое соединение с химической формулой
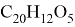
Разлагается при температуре 290 °C. Трудно растворим в воде, лучше в спирте, еще легче в щелочах [4]. Также хорошо растворяется в горячей уксусной кислоте, метиловом спирте, муравьиной кислоте. С щелочами он образует желтовато-красный раствор с чрезвычайно сильной зеленой флуоресценцией. Яркость флуоресценции растёт вместе с щелочным показателем среды. Может образовывать различные производные с галогенами и соли с металлами (эозин — производное от брома; эритрозин — производное от йода и натрия; уранин — натриевая соль флуоресцеина; флуорексон — производное с азотом).
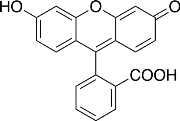
Рис. 4. Структурная формула флуоресцеина
Источник: https://ru.wikipedia.org/wiki/Флуоресцеин
- Применение флуоресцеина в разных сферах деятельности.
3.1. Использование флуоресцеина в качестве красителя и индикатора.
В разных сферах деятельности флуоресцеин используют в качестве индикатора. К примеру, его используют для обнаружения воды в жидкостях, где ее растворимость ограничена, например, в ракетном топливе. Полоски с нанесённым индикатором помещают в исследуемую жидкость и облучают УФ-светом. В присутствии воды наблюдается желто-зеленая флуоресценция. В аналитической химии используется в флуоресцентная хроматографии.
3.2. Применение флуоресцеина в научных исследованиях.
Флуоресцентные технологии нашли широкое применение в различных прикладных биологических и биомедицинских исследованиях. Многие направления в молекулярной биологии и биофизике возникли именно благодаря появлению новых методов, базирующихся на флуоресценции.
Флуоресцентные красители, применяемые в биологии, можно условно разделить на две большие группы:
Флуоресцентные метки служат для того, чтобы идентифицировать наличие или пространственное положение исследуемой молекулы. Флуоресцентная метка должна быть химически стабильной и демонстрировать стабильную флуоресценцию, которая не зависит от внешних факторов и минимально меняется во времени. Таким образом, она действует как пассивный «маяк», который сигнализирует о месте нахождения молекулы, к которой привязана;
Флуоресцентный зонд является более сложным по своим функциям. Это молекулярная конструкция, которая может существовать в двух состояниях: «выключенном» и «включённом». Эти состояния различаются между собой определёнными параметрами флуоресцентной эмиссии (чаще всего квантовым выходом флуоресценции, позицией максимума в спектре эмиссии или временем жизни возбуждённого состояния). Переход между «включён» и «выключен» состояниями зависит от наличия в среде зонда тех молекул, которые он должен распознавать.
Метод секвенирования ДНК по Сэнгеру был значительно усовершенствован во второй половине 1980-х годов именно благодаря внедрению флуоресцентной детекции. Это позволило ускорить процесс секвенирования и повысить его надёжность. Кроме того, стала возможна автоматизация метода. Появилась возможность проведения широкомасштабного секвенирования, что позволило начать проект «Геном человека» в начале 1990-х годов. Хотя в наши дни метод Сэнгера почти полностью вышел из использования, флуоресценция продолжает использоваться в технологиях секвенирования ДНК следующих поколений.
Флуоресценция дала новый толчок развитию клеточной биологии. Благодаря конфокальной флуоресцентной микроскопии и разработке новых флуоресцентных меток на базе зелёного флуоресцентного белка (ЗФБ) и его аналогов появилась возможность получать специфически контрастную окраску и делать фотоснимки с высоким разрешением многих внутриклеточных белковых структур. Разработка новых флуоресцентных зондов — веществ, изменяющих флуоресценцию, когда к ним присоединяется определённая молекула — дала возможность детально исследовать химический состав живых клеток и даже организмов, а также его изменение во времени и пространстве, что положило начало флуоресцентному молекулярному имиджингу (англ. molecular imaging).
Большинство биогеологических исследований строятся на изучении кернов — срезов горных пород, полученных путём бурения специальных скважин. Для мониторинга изменений в местных микробных сообществах и изучения их взаимодействия с геотехническими установками нужны керны, незагрязнённые посторонними химическими веществами. Однако процедуры бурения и технические жидкости, особенно буровой раствор, являются источниками загрязнения керна. Для измерения проникновения бурового раствора в керны индикаторный флуоресцеин был протестирован как в лабораторных, так и в полевых условиях [5].
Ещё раствор флуоресцеина использовался в качестве индикатора в экспериментах по испарению, так как он способен менять свой цвет в зависимости от концентрации [6].
В ботанических исследованиях флуоресцеин и красители на его основе используются для мониторинга и изучения сосудистой сети растений, в частности ксилемы, которая является основным путем транспортировки воды в растениях. Это связано с тем, что флуоресцеин подвижен в ксилеме и не способен проникать через плазматические мембраны, что делает его особенно полезным для отслеживания движения воды через ксилему. Флуоресцеин может быть введен в сосуды растения через корни или срезанный стебель. Краситель может всасываться в растение так же, как вода, и перемещается от корней к верхушке растения за счет транспирационного притяжения. Флуоресцеин, который был поглощен растением, можно визуализировать под флуоресцентным микроскопом [7].
3.3. Роль флуоресцеина в медицине.
Флуоресцентные красители применяются в медицинских анализах и исследованиях благодаря биосовместимости и высокой контрастности. Внутривенный или пероральный флуоресцеин используется в флуоресцентной ангиографии и офтальмологии в исследованиях и при диагностике сосудистых заболеваний, включая заболевания сетчатки, дегенерацию желтого пятна, диабетическую ретинопатию, воспалительные внутриглазные заболевания и внутриглазные опухоли [8].
Применение флуоресцеина в нейрохирургии тоже имеет важное значение. Его способность накапливаться в областях мозга, где произошло повреждение гематоэнцефалического барьера, делает его особенно подходящим в качестве красителя для интраоперационной (происходящей во время операции) визуализации злокачественных глиом (МГС). Красители также применяются в сосудистой нейрохирургии [9, 10].
Относительно недавно флуоресцеин натрия (FNa) начал использоваться в кардиохирургии при волоконно-оптической конфокальной микроскопии (FCM) для интраоперационного определения местоположения участков проводящей ткани во время операций на сердце.
3.4. Преимущества и недостатки использования флуоресцеина.
К явным преимуществам флуоресцентных красителей, применяемых в исследованиях, можно отнести несколько особенностей данных веществ:
Сверхвысокая чувствительность.
По своей чувствительности флуоресценция является абсолютным рекордсменом, превосходя методы детекции, базирующиеся на поглощении света или использовании радиоактивного распада. Современные инструменты могут идентифицировать отдельные флуоресцентные молекулы. Это способствовало даже развитию отдельного направления — одномолекулярной флуоресцентной спектроскопии (ОФС, англ. Single Molecule Fluorescence Spectroscopy). Данный вид спектроскопии открыл новые возможности для изучения биологических систем на молекулярном уровне. Одномолекулярная флуоресцентная спектроскопия стала важным методом исследования, сочетающим возможность наблюдать за отдельными молекулами с возможностью исследовать их в динамике и при биологически-релевантных условиях. Например, именно благодаря ОФС стало возможным изучать сворачивание и динамику белков и ДНК на уровне отдельных молекул. Также на основе ОФС были созданы методы для секвенирования отдельных молекул ДНК и для наблюдения за отдельными флуоресцентными молекулами в клетке с использованием флуоресцентной микроскопии сверхвысокого разрешения
Мультиплексность детекции.
Существует большое количество флюорофоров, каждый из которых характеризуется определённым максимумом эмиссии (цветом флуоресценции). Это открывает возможность для мультиплексной детекции, то есть для наблюдения за несколькими объектами одновременно, если они закодированы флюорофорами с разными цветами эмиссии.
Совместимость с живыми организмами.
Это даёт возможность проводить исследования с использованием флуоресценции на живых клетках и даже целых организмах. Видимый флуоресцентный свет не поглощается биологическими макромолекулами, водой и другими компонентами живых клеток и не влияет на процессы, происходящие в клетке [6].
Такая особенность позволила разработать многочисленные биосовместимые флюорофоры и флуоресцентные зонды. Среди них особенно выделяются флуоресцентные белки.
Высокая скорость ответа .
Флуоресценция является очень быстрым процессом, который происходит в наносекундной шкале времени (в случае отдельных комплексов металлов — в микросекундной). За секунду одна молекула флюорофора может излучить миллионы фотонов, каждый из которых содержит информацию об окружении, в котором находилась молекула непосредственно перед эмиссией. Благодаря этому флуоресценцию удобно использовать для исследования быстрых процессов, таких как сворачивание и динамика отдельных белковых молекул
Высокое пространственное разрешение.
Пространственное разрешение метода указывает, на каком минимальном расстоянии должны находиться объекты для того, чтобы их можно было однозначно различить. Пространственное разрешение очень важно в исследованиях живых систем на микроскопическом уровне. Линейный размер отдельных клеточных структур, таких как, например, ядерные поры, может составлять десятки нанометров, что делает их недосягаемыми для классической оптической микроскопии.
Благодаря некоторым особенностям процесса флуоресценции, таким как, например, возможности управляемо избавляться от нежелательной эмиссии на определённых участках образца с помощью дополнительного облучения (англ. stimulated emission depletion,) в конце XX века были разработаны методы оптической микроскопии сверхвысокого разрешения (англ. super resolution microscopy).
Среди недостатков флуоресцентных технологий можно выделить некоторые побочные эффекты при применении в медицине. К примеру, после инъекции может произойти экстравазация (попадание препарата) флуоресцеина под кожу. Это может быть чрезвычайно болезненным и может привести к ряду неприятных симптомов. К достаточно редким осложнениям можно отнести токсический неврит, вызванный инфильтрацией экстравазированного флуоресцеина вдоль нерва в локтевой области. Данный побочный эффект может привести к сильной боли на срок до нескольких часов.
-
Синтез флуоресцеина и
его производных.
- Методики синтеза флуоресцеина, использованные нами в работе.
Методика 1.
Флуоресцеин (C 20 H 12 O 5 ) получают конденсацией фталевого ангидрида (C 8 H 4 O 3 ) с резорцином (С 6 H 6 O 2 ) в присутствии хлористого цинка (см. рис. 5). Реакция проводится при температуре 175–195 °C:
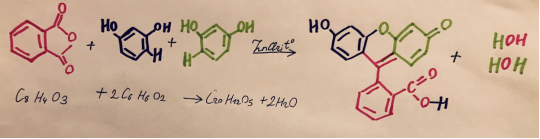
Рис. 5. Реакция синтеза флуоресцеина
Реактивы: фталевый ангидрид, резорцин, хлористый цинк, соляная кислота (конц.).
Оборудование: ступка с пестиком, фарфоровый тигель, стеклянная палочка, плитка, воронка Бюхнера.
Ход работы:
Тщательно разотрите в ступке 1,5 г фталевого ангидрида с 2,2 г резорцина и нагрейте смесь до 180°С в фарфоровом тигле.
Когда смесь будет расплавлена, внесите в нее в течение 10 мин при помешивании стеклянной палочкой 3,5 г хлористого цинка (предварительно обезвоженного сплавлением и затем измельченного в порошок). Затем поднимите температуру смеси до 210°С и нагревание продолжайте до тех пор, пока постепенно густеющая масса не станет совершенно твердой. Для этого потребуется 1–2 часа.
Охлажденный хрупкий плав достаньте из тигля (откалывая его каким-нибудь острым инструментом), тонко измельчите и 10 мин прокипятите в фарфоровой чашке с 50 мл воды, к которой прибавлено 5 мл концентрированной соляной кислоты. При этом не вступившие в реакцию исходные вещества и основная соль цинка переходят в раствор. Затем отфильтруйте флуоресцеин от водного раствора, промойте водой до тех пор, пока фильтрат не перестанет показывать кислую реакцию, и высушите на водяной бане.
Методика 2.
Другая использованная методика отличается от предыдущей использованием ортофосфорной кислоты в качестве конденсирующего агента.
Вещества и материалы (см. рис. 6):
— 2 — фталевый ангидрид (C 8 H 4 O 3 );
— 3 — резорцин (C 6 H 6 H 2 )
— 5 — хлорид цинка (ZnCl 2 )
— ортофосфорная кислота (H 3 PO 4 )
— 6 — фарфоровая ступка
— 7 — шпатель
— 4 — мерный стаканчик
— стеклянные пробирки
— стеклянная палочка
— 1 — ювелирные весы
— лабораторная плитка.
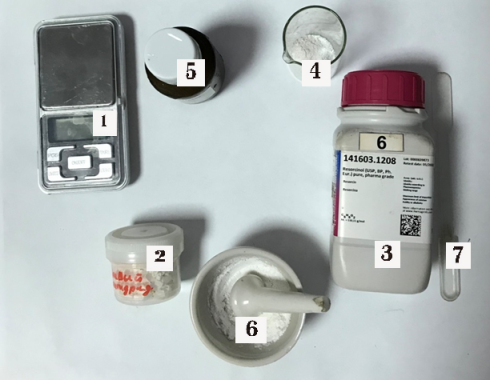
Рис. 6. Вещества и материалы
Ход работы:
- Смешиваем фталевый ангидрид с резорцином в пропорции 2,2 г:1,5 г., перетираем вещества в фарфоровой ступке.
- Насыпаем полученную порошковую смесь в пробирки так, чтобы в обеих оказалось поровну вещества. Ставим пробирки на плиту и греем до 180 °C. Смесь начала плавиться при температуре 150 °C, приобретая желтоватый цвет.
- Когда смесь достаточно расплавилась, в течение 10 минут вносим в первую пробирку при помешивании стеклянной палочкой 4 г. ортофосфорной кислоты. Продолжаем греть смесь до затвердевания. После добавления в первую пробирку ортофосфорной кислоты, разогретой до нужной температуры, смесь приобрела тёмно-коричневый цвет. Аналогичное изменение цвета смеси мы наблюдали при добавлении 3,5 г. порошка хлорида цинка во вторую пробирку, за исключением того, что соль некоторое время лежала на дне пробирки (см. рис. 7).

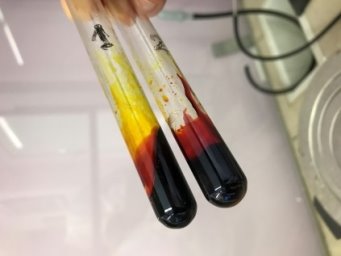
Рис. 7. Пробирки с готовящимся флуоресцеином. Видно, как соль некоторое время лежит на дне второй пробирки
- Смеси в обеих пробирках закипели при температуре примерно в 200 °C. Через 10 минут после нагрева до вышеуказанной температуры смесь во второй пробирке начала густеть.
- Мы получили твёрдый флуоресцеин (C 20 H 12 O 5 ). Для его извлечения нам пришлось разбить пробирку (см. рис. 8). При добавлении его порошка в воду, мы получаем раствор флуоресцеина. Это жидкость прозрачного жёлтого цвета. Раствор флуоресцеина приобретает ярко-зелёный цвет при прохождении через него ультрафиолетового излучения. Мы можем наблюдать такой эффект благодаря особому строению молекулы этого вещества (электроны свободно переходят по всему соединению). Синтез с использованием ортофосфорной кислоты прошёл менее удачно. Дальнейшие опыты проводились с флуоресцеином из 2 пробирки (см. рис 8).
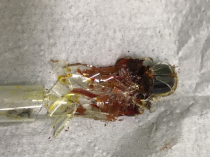


Рис. 8. Разбитая пробирка с твёрдым флуоресцеином, и способный светиться в ультрафиолете флуоресцеиновый раствор
Производим отмывку продукта синтеза от примесей. Тонко измельченный флуоресцеин заливаем водой 30 мл и 10 мин греем на песчаной бане, к раствору добавляем 5 мл концентрированной соляной кислоты (см. рис. 9).


Рис. 9. Очистка флуоресцеина
По истечении 10 мин отфильтровываем полученного раствор до тех пор, пока фильтрат не перестал показывать кислую реакцию, и высушили его путём естественного выпаривания. В конечном итоге мы получили оранжево-красный порошок флуоресцеина (см. рис. 10).

Рис. 10. Флуоресцеин до и после очистки
Выделив чистый порошок флуоресцеина, мы приступили к получению производных этого вещества (см. рис. 11).
4.2. Получение производных флуоресцеина.

Рис. 11. Пробирки с растворами флуоресцеина и других веществ
- Нитрование флуоресцеина нитрующей смесью (H 2 SO 4 +HNO 3 );
- Нейтрализация флуоресцеина: добавление KOH;
- Добавление концентрированного аммиака к флуоресцеину (см. рис. 11 и 12);
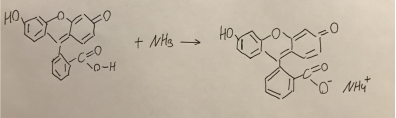
Рис. 12. Реакция взаимодействия флуоресцеина и аммиака
- Иодирование флуоресцеина.
Катализаторы: AlCl 3 +HCl; реактив: I 2 (см. рис. 11 и 13);
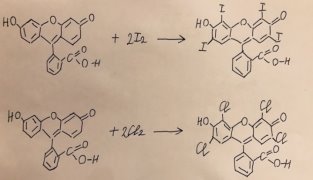
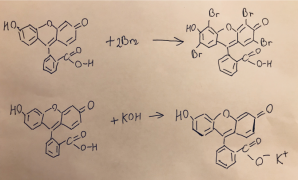
Рис. 13. Реакции галогенирования и нейтрализации флуоресцеина
- Взаимодействие флуоресцеина с перекисью водорода (реакция окисления);
6–7. Взаимодействие флуоресцеина со спиртами:
Флуоресцеин + спирт(щел.);
Флуоресцеин + спирт(кисл.).
Результаты наших экспериментов.
Мы можем наблюдать очевидные признаки реакции в пробирках 2, 3 (скорее всего, произошла нейтрализация флуоресцеина) и 4 (предположительно, получился безнатриевый эритрозин).
Визуальные эффекты свидетельствуют о прохождении реакции: раствор в пробирках 2 и 3 потемнел, в пробирке 4 выпал осадок. Раствор йода с флуоресцеином на бумаге даёт желтый цвет, тускнеющий со временем (см. рис. 14).
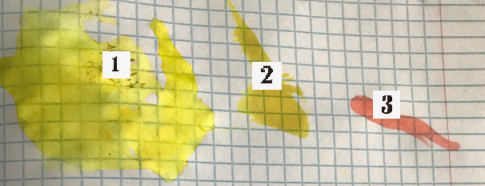
Рис. 14. Спиртовые растворы флуоресцеина с галогенами (2 — с йодом; 3 — бромом) и первоначальное вещество (1) на бумаге
Галогенирование флуоресцина.
Для проведения галогенирования мы получили нужные галогены. Хлор был получен в ходе взаимодействия манганата калия и соляной кислоты (см. рис. 15).
Бром является продуктом реакции раствора бромида калия с соляной кислотой (2KBr + Cl 2 = 2KCl + Br 2 — реакция замещения). Нужно для полного прохождения реакции подождать несколько дней (примерно неделю).


Рис. 15. Водные растворы флуоресцеина с разными веществами и их получение (1 — флуоресцеин с хлорной водой; 2 — раствор флуоресцеина с бромной водой; 3 — раствор флуоресцеина с хлором)
Через неделю мы можем наблюдать осадок в растворах с хлорной и бромной водами, в третьей пробирке мы наблюдаем однородную среду, так как при взаимодействии с хлором произошла нейтрализация флуоресцеина (см. рис. 16).
Раствор с бромной водой в начале реакции имел ярко-оранжевую окраску, при контакте с бумагой оставлял красно-розовые следы, тускнеющие через некоторое время (см. рис. 14).

Рис. 16. Пробирки с растворами флуоресцеина и других веществ через неделю
Раствор с хлорной водой флуоресцирует лучше растворов с бромной водой и однородной хлорно-флуоресцеиновой средой (см. рис. 17).

Рис. 17. Разница в флуоресценции.
Так происходит из-за большего pH в пробирке с хлорной водой.
Возможность использования флуоресцеина в качестве индикатора.
Теперь мы знаем, что яркость в растворе растёт с щелочностью среды. Это свойство делает флуоресцеин отличным индикатором для определения среды исследуемого раствора.
5. Предлагаемая нами методика синтеза флуоресцеина и его производных для школьного практикума по органической химии 10 класса.
Продолжительность работы — 1,5 часа.
Оборудование: фарфоровая ступка, шпатель, мерный стаканчик, стеклянные пробирки, стеклянная палочка, ювелирные весы, лабораторная плитка.
Реактивы: сухой безводный хлорид цинка, резорцин, фталевый ангидрид.
Часть 1. Получение флуоресцеина.
- Поместить в фарфоровую ступку 1,1 г фталевого ангидрида и 0,75 г резорцина. Перетереть вещества до однородной массы.
- Перенести полученную порошковую смесь в пробирку. Пробирки поместить на песчаную баню и греть примерно до 180 °C. Температуру контролировать по температуре песка.
- Когда смесь полностью расплавится, внести в неё 3,5 г хлорида цинка при помешивании стеклянной палочкой. Продолжать греть смесь до загустевания.
- Охладить полученную смесь до комнатной температуры. Извлечь продукт синтеза из пробирки и растереть в ступке. В коническую колбу на 100 мл внести несколько крупинок продукта и залить 50 мл воды. Проверить полученный раствор на наличие флуоресценции (можно использовать источник ультрафиолетового света или свет из окна в дневное время). При недостаточно явном эффекте растворить ещё небольшое количество продукта. Описать цвет раствора в проходящем и в отраженном свете.
- В отдельной пробирке 2–3 мл раствора флуоресцеина нейтрализовать щёлочью.
Часть 2. Получение производных флуоресцеина.
Приготовить и поместить по 2–3 мл спиртового раствора флуоресцеина в три пробирки. Провести реакцию с хлорной, бромной и йодной водой. Описать полученный результат.
Выводы.
Искомый продукт (флуоресцеин) и ряд его производных были нами успешно получены. Также нами была разработана и протестирована методика проведения синтеза флуоресцеина в условиях школьной лаборатории.
Литература:
- Gessner T., Mayer U. Triarylmethane and Diarylmethane Dyes. Ullmann's Encyclopedia of Industrial Chemistry. 2000.
- Valeur B., Berberan-Santos N. M. A Brief History of Fluorescence and Phosphorescence before the Emergence of Quantum Theory. Journal of Chemical Education. 2011; 88(6): 731–738.
- Пучков Е. Флуоресцентные репортеры и их молекулярные репортажи. Доступно по ссылке на 28.09.2024 https://biomolecula.ru/articles/fluorestsentnye-reportery-i-ikh-molekuliarnye-reportazhi?ysclid=m1lyb4hhd5710599882
- Кнунянц И. Л. Химический энциклопедический словарь. Москва: Советская энциклопедия, 1983.
- Бадикова А. Д., Кудашева Ф. Х., Тептерева Г. А., Яхин А. Р., Мухаматдинова Л. Р., Ялалова Р. А., Якунова Н. А., Алехина И. Е. Возможности рентгенофлуоресцентного спектрального метода при определении элементного состава кернового материала. Вестник Башкирского университета. 2015; 4: 1189–1191.
- Lakowicz J. R. Principles of Fluorescence Spectroscopy. New York: Springer, 2006.
- Drummen, G. P. C. Fluorescent Probes and Fluorescence (Microscopy) Techniques — Illuminating Biological and Biomedical Research. Molecules. 2012; 17(12): 14067–14090.
- Kaza A. K., Mondal A., Piekarski B. et al. Intraoperative localization of cardiac conduction tissue regions using real-time fibre-optic confocal microscopy: first in human trial. European Journal of Cardio-Thoracic Surgery. 2020; 58(2): 261–268.
- Acerbi F., Cavallo C., Broggi M. et al. Fluorescein-guided surgery for malignant gliomas: a review. Neurosurgical Review. 2014; 37: 547–557.
- Zhao X., Belykh E., Cavallo C. et al. Application of Fluorescein Fluorescence in Vascular Neurosurgery. Frontiers in Surgery. 2019; 6 (52): 1–13.












