Статья посвящена изучению влияния загрязнённости почвы на рост и развитие растений. Исследуются ключевые аспекты фитотоксичности, обусловленной наличием тяжёлых металлов, нефтепродуктов и других химических загрязнителей. Особое внимание уделяется механизмам адаптации растений к изменённым почвенным условиям и выявлению предельных концентраций токсичных веществ, вызывающих негативные изменения.
Целью исследования является оценка воздействия загрязнённой почвы на физиолого-биохимические показатели растений, включая длину корней и высоту стеблей. Представлены методики анализа фитотоксичности, включая тестирование модельных организмов (овса, амаранта) путём обработки их водными экстрактами почв различного происхождения. В результате лабораторных испытаний установлено, что обработка растений водными вытяжками из почв, загрязнённых железнодорожным транспортом, уменьшает среднюю длину корней и стеблей, в то время как образцы почвы из прибрежной зоны демонстрируют стимулирующий эффект. Полученные результаты позволяют рекомендовать определённые виды растений для биоиндикации и последующей реабилитации загрязнённых участков. Выводы статьи важны для практических рекомендаций по выбору устойчивых видов растений для озеленения загрязнённых территорий и созданию экологически ориентированных программ мониторинга состояния почв. Обзор новейшей отечественной литературы подтверждает уникальность полученных результатов и позволяет предложить новые подходы к биоиндикационным технологиям.
Ключевые слова: растения-индикаторы, водные экстракты почв, фитотоксичность, загрязнение почвы, адаптация растений.
This article is dedicated to the study of the impact of soil contamination on plant growth and development. Key aspects of phytotoxicity, attributed to the presence of heavy metals, petroleum products, and other chemical pollutants, are investigated. Particular attention is given to the mechanisms of plant adaptation to altered soil conditions and the identification of threshold concentrations of toxic substances that induce adverse changes.
The objective of the research is to assess the effect of contaminated soil on plant physiological and biochemical indicators, including root length and stem height. Methods for analyzing phytotoxicity are presented, encompassing the testing of model organisms (oats, amaranth) through treatment with aqueous soil extracts of varying origin. Laboratory tests have demonstrated that the treatment of plants with aqueous extracts from soils contaminated by railway transport reduces the average root and stem length, whereas soil samples from the coastal zone exhibit a stimulating effect. The obtained results allow for the recommendation of specific plant species for bioindication and subsequent remediation of contaminated sites. The article’s conclusions are relevant for practical recommendations regarding the selection of resistant plant species for the greening of polluted areas and the establishment of ecologically-oriented soil condition monitoring programs. A review of recent domestic literature confirms the uniqueness of the obtained results and enables the proposition of novel approaches to bioindication technologies.
Keywords: indicator plants, aqueous soil extracts, phytotoxicity, soil contamination, plant adaptation.
Загрязнение почвы является одной из важнейших экологических проблем нашего времени, которая существенно влияет на окружающую среду и особенно на растения. Накопление в почве вредных веществ — тяжелых металлов, нефтепродуктов, пестицидов и других химических соединений — приводит к значительным изменениям в составе и свойствах почвы. В современных условиях особенно важно изучать, как растения приспосабливаются к неблагоприятным факторам среды и как они реагируют на различные загрязнители. Растения, производящие органические вещества в процессе фотосинтеза и являющиеся основой наземных экосистем, напрямую взаимодействуют с почвой через свои корни. Это делает их очень чувствительными к изменениям почвенных условий. Загрязнение почвы вызывает цепь биохимических и физиологических изменений в растениях, которые проявляются на разных уровнях их организации. [1, с. 97] Нарушение питания растений, снижение активности ферментов, повреждение клеток и изменение гормонального баланса неизбежно отражаются на процессах роста и развития растений. Несмотря на большое количество данных о вредном воздействии различных загрязнителей на растения, многие вопросы остаются недостаточно изученными. В частности, требуют дальнейшего исследования особенности реакций разных видов растений, предельные концентрации загрязнителей, вызывающие необратимые нарушения, а также способы приспособления растений к загрязненной почве. Кроме того, интересно изучение возможностей использования растений для очистки загрязненных территорий. Данное исследование направлено на всестороннюю оценку влияния различных типов почвенного загрязнения на рост, развитие и биохимические показатели растений, что поможет лучше понять механизмы вредного воздействия загрязнителей и разработать подходы к наблюдению и восстановлению поврежденных почв.
Как определить токсичность почвы
Фитотоксичность почвы — это свойство почвы негативно воздействовать на растения из-за содержания в ней токсичных веществ, таких как тяжелые металлы, пестициды и органические загрязнители. Это приводит к нарушению физиологических процессов у растений, замедлению их роста, снижению продуктивности и возможному увяданию. Изучение фитотоксичности важно для оценки экологического состояния почв.
Фитотоксический эффект почвы проявляется в виде торможения роста корней, хлороза растений, нарушения обмена веществ, задержки поступления питательных веществ, угнетения дыхательной функции и других негативных последствий. Повышенная токсичность почвы может быть обусловлена различными факторами, среди которых выделяются образование вредных метаболитов, транспортная инфраструктура, Использование пестицидов и удобрений, межорганизменные взаимодействия, промышленная деятельность, мусорные полигоны и свалки, неблагоприятные физико-химические параметры среды и загрязнение почвы в результате человеческой деятельности.
Оценка степени опасности и уровня безопасности отходов основана на экспериментальной зависимости величины фитотоксического эффекта от концентрации водного экстракта, выражаемой уравнением линейного типа:
y=mx+by=mx+b.
Учитывая прямолинейный характер этой зависимости, где x соответствует величине фитоэффекта, а y — логарифму разведения экстракта, параметры фитотоксичности (LimR и ER50) определяются посредством регрессионной модели:
$$ \lg R = -mET + b,
где ET — фитоэффект, полученный в эксперименте; R — степень разведения экстракта отхода; m — коэффициент, соответствующий каждому значению фитоэффекта; b — коэффициент регрессии. Коэффициенты уравнения m и b вычисляются отдельно для каждого отхода на основе экспериментальных данных. Уровень опасности отхода относительно фитотоксической активности определяется показателем ER50.
Тест-объект
Методика предусматривает проведение фитотестирования отходов с использованием в качестве модельного объекта семян овса. Этот выбор обоснован результатами предварительных исследований по эколого-гигиенической оценке отходов разного химического состава, согласно которым семена овса продемонстрировали наибольшую стабильность и воспроизводимость показателей по сравнению с семенами других культур (таких как горох, огурцы, пшеница, морковь и др.). Для экспериментов отбираются здоровые, неповрежденные семена овса с всхожестью не менее 95 %.
Метод воздействия отхода на тест-объект
Фитотоксичность отхода определяется по биологическому действию его водного экстракта. Исследование проводится в условиях непосредственного контакта тест-растений с экстрактом отхода или его разведениями. Проращивание семян выполняется в чашках Петри на фильтровальной бумаге, пропитанной водным экстрактом исследуемого отхода. Этот метод отличается простотой исполнения и удобством в техническом плане.
Материалы и оборудование
— Термостат с поддерживаемой температурой 20–23°C.
— Термостат для стерилизации чашек Петри.
— Весы для взвешивания образцов отходов.
— Колбы объёмом ≥ 100 мл для приготовления экстрактов.
— Колбочки с притёртыми пробками для хранения рабочих растворов.
— Чашки Петри.
— Фильтровальная бумага для проращивания семян.
— Пипетки объёмом 5 мл.
— Стеклянные палочки с загнутым концом.
— Пинцет для извлечения пророщенных семян.
— Линейка для измерения длины корешков проростков. [2,с.2]
Подготовка образца отхода для исследования
Экстрагентом для извлечения химических веществ из отходов служит дистиллированная вода с начальным уровнем pH 6,1–6,3.
Рекомендуемое соотношение фазы «отход/экстрагент» составляет 1:10. Навеску отхода массой 10 г помещают в мерную колбу объёмом 100 мл и доводят до метки дистиллированной водой.
После тщательного перемешивания колба с экстрактом отстаивается при комнатной температуре в течение суток, затем подвергают двухчасовому встряхиванию на аппарате «Шутель» и фильтруют через фильтр «синяя лента».
Проведение эксперимента
Исследования включают три основных этапа:
- Проверка семян на всхожесть. Семена проверяются на всхожесть перед началом основного опыта. (Контрольные измерения)
- Рекогносцировочный опыт проводится для определения диапазона фитотоксического действия. В рамках данного этапа испытывают нативный экстракт (R = 1) и его разведения, кратные 10 (R = 10, 100, 1000 и т. д.).
- Основной опыт направлен на уточнение параметров фитотоксичности. В нём тестируют разведения, кратные 2–3 в пределах биологически активных концентраций, установленных на первом этапе.
Каждое испытание проводят с не менее чем тремя повторами. Минимум три разведения используются в каждом исследовании.
Последовательность действий:
Чашки Петри с вложенной фильтровальной бумагой стерилизуют и охлаждают. На внешнюю сторону крышки наносят маркировку, указывающую название пробы (контроль, отход) и значение R.
В каждую чашку помещают не менее, чем по 25 здоровых семян овса с всхожестью не менее 95 %. [2, с. 3]
Для проверки всхожести используют дистиллированную воду, которую добавляют на фильтровальную бумагу в объёме 5 мл. Чашки закрывают и помещают в термостат при температуре 20–23°C на трое суток, после чего определяют процент всхожести.
В опытные чашки добавляют по 5 мл экстракта отхода или его разведений, тогда как контрольные семена обрабатывают эквивалентным количеством дистиллированной воды. Образцы оставляют в термостате на семь дней.
По окончании периода экспозиции измеряют длину корней проростков в контрольных и опытных образцах, фиксируя максимальную длину корня у каждого семени.
Результаты измерений заносятся в таблицу.
Определение фитотоксического эффекта
Фитотоксический эффект определяется сравнением показателей тест-функции (средняя длина корней, Lср контрольных и опытных семян). Средние значения Lср — вычисляют как среднее арифметическое длин корней проростков, полученных в трёх повторностях эксперимента:
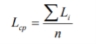
где L(i) — длина максимального корня каждого семени в миллиметрах, ∑ — сумма всех значений, n — общее количество семян в опыте.
Отсутствие неблагоприятного воздействия отхода фиксируется, если
Lср(опыт)⩾Lср (контроль)
Величину эффекта торможения рассчитывают по формуле:
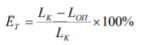
где ET — эффект торможения в процентах, L ОП — средняя длина корней в опыте, LК — средняя длина корней в контроле.
Фитотоксическое действие признаётся доказанным, если величина ET превышает 20 %.
Результаты оформляются в таблице.
Регрессионный анализ экспериментальных данных
Регрессионный анализ проводится, если в эксперименте задействованы не менее трёх биологически эффективных разведений (R). Уравнение регрессии: lg R = — mET+b, описывающее зависимость lg R = f(EТ), рассчитывается методом наименьших квадратов. Рекомендуется использовать компьютерные программы, такие как Microsoft Excel, для упрощения расчётов параметров m и b. [2, с. 3–4]
Оценка достоверности регрессионного уравнения производится по коэффициенту корреляции (r), который отражает степень соответствия экспериментальных и расчётных значений фитоэффектов. Значение r варьируется от 0 до 1: r=1 означает полную корреляцию, r=0 свидетельствует о недостаточной точности модели.
Какие растения выбрать
Для эффективного использования биологических объектов в качестве индикаторов антропогенного воздействия необходимо учитывать ряд критериев, в том числе высокую чувствительность в сочетании с минимальной внутривидовой изменчивостью, генетическую однородность исследуемых образцов, доступность репрезентативной выборки, широкий диапазон экологической толерантности, простоту визуальной индикации, продолжительный жизненный цикл и воспроизводимость результатов. Кроме того, целесообразно использовать объекты, демонстрирующие совокупную реакцию на различные типы биологических эффектов, в том числе мутагенные и токсические. В соответствии с указанными критериями, в качестве перспективного рассматривается в зависимости от видовой принадлежности и физиологических особенностей корневой системы, определяющих степень ограничения поступления токсикантов в надземные органы. В частности, свинец, хром, ртуть поглощаемый корневой системой, характеризуется высокой степенью связывания в почвенном комплексе, что ограничивает его транслокацию в надземные органы. В отличие от свинца, такие элементы, как кадмий, цинк, медь и никель активно транспортируются из почвы в надземные органы, что может приводить к нарушению метаболических процессов и, как следствие, к ухудшению ростовых характеристик растений. Визуальными признаками негативного воздействия являются хлорозы и увядание, однако в ряде случаев токсическое воздействие проявляется исключительно в снижении продуктивности без проявления данных признаков. Распределение металлов в органах растений подчиняется акропетальному градиенту (корни > стебли > листья > плоды). В качестве перспективного фитоиндикатора предложена культура амаранта, характеризующаяся высокими сорбционными свойствами, обусловленными высоким содержанием кальция в листьях и способностью накапливать соединения кремния, что обеспечивает эффективное поглощение токсичных элементов, в том числе углеводородов, из нефтезагрязненных почв. Экспериментально подтверждено, что амарант способствует ускорению метаболизма загрязняющих веществ, что приводит к снижению концентрации нефти в почве с 66,4 до 24,8 мг/кг за один вегетационный период.
Для оценки воздействия загрязнённых почв на растения использовали неповреждённые семена овса с высокой лабораторной всхожестью 95 %. Внешние симптомы повреждений проявлялись в виде хлороза и снижения урожайности, что свидетельствует о негативном влиянии токсикантов на физиологические процессы. Для сравнительной оценки чувствительности к загрязнителям были использованы культуры пшеницы и кресс-салата.
Таким образом, результаты проведённых исследований подтверждают перспективность использования фитоиндикации для мониторинга загрязнения окружающей среды. Использование амаранта представляет собой перспективный подход к оценке и потенциальной рекультивации нефтезагрязнённых почв. Дальнейшие исследования направлены на выявление наиболее эффективных видов растений-индикаторов и разработку методик количественной оценки степени загрязнения на основе биоиндикационных показателей.
Эксперименты
Итак, для того чтобы провести эксперимент с проращиванием растений, нужно проверить, насколько эти семена способны к прорастанию в стандартным условиях. Такими условиями будут являться:
- Полив дистиллированной водой
- Количество семян 60 штук
- Определенная постоянная температура 24–27 ˚C
Взяв один вид пшеницы и один вид кресс-салата у двух различных производителей, были проведены контрольные измерения значений и проверка на всхожесть.
Проведем оценку всхожести семян для каждого вида объектов.
Таблица 1
Результаты количества взошедших семян в контрольной группе
|
Название вида объекта |
Сколько растений взошло |
Сколько растений было посажено |
|
АЭЛИТА 60 контроль |
57 |
60 |
|
Gavrish 60 контроль |
47 |
60 |
|
Пшеница 60 контроль |
57 |
60 |
Результаты и выводы эксперимента № 1
Рассчитаем процент всхожести:
— АЭЛИТА 60 контроль = (57)/(60) ˑ100 % = 95 %
— Gavrish 60 контроль = (47)/(60) ˑ100 % = 78,3 %
— Пшеница 60 контроль = (57)/(60) ˑ100 % = 95 %
Выборка считается действительной, если процент всхожести больше 95 %
Так как в Gavrish этот процент значительно ниже нормы, далее опыты с его использованием проводиться не будут.
Также посчитаем среднее значение длины корня и стебля в контрольной группе.
Средняя длина корня пшеницы: Lср=(2598)/(57)=45,6 мм
Средняя длина стебля пшеницы: Lср=(3401)/(57)=59,7 мм
Средняя длина корня кресс-салата: Lср=(1352)/(57)=23,7 мм
Средняя длина стебля кресс-салата: Lср=(1197)/(57)=21
Эксперимент № 2
Проведем второй опыт с участием водной вытяжки на основе почвы, взятой около железнодорожных путей. Отбор проб почвы производится на исследуемом участке. Почву отбирают с помощью ножа, на делянке выбирают три площадки размером по 1 м2. Почва, взятая из нескольких точек верхнего слоя (0‒10 см), помещается в полиэтиленовый мешочек. [4, с. 2]
Для получения водной вытяжки необходимо 100 г просеянной сухой земли и 500 мл дистиллированной воды. Полученный раствор нужно профильтровать до получения бесцветной жидкости.
Результаты и выводы эксперимента № 2: Пшеница 60 ж\д
Средняя длина стебля пшеницы (э. 1): Lср=(2651)/(59)=45
Средняя длина корня пшеницы (э.1): Lср=(2418)/(59)=41
АЭЛИТА 60 Средняя длина корня кресс-салата (э.1) Lср=(1326)/(58)=22,8
Средняя длина стебля кресс-салата(э.1) Lср=(1127)/(58)=19,4
Исходя из полученных результатов мы можем сделать вывод, что растения стали приспосабливаться к новым условиям, а именно к другому составу воды. Растения пшеницы начали выпускать больше корней, но они стали меньше в размере. У растений кресс-салата стебель стал менее насыщен цветом и немного короче, чем у контроля. Но в общем средние значения контроля не отличаются более, чем на несколько единиц.
Диаграмма, наглядно демонстрирующая различия:
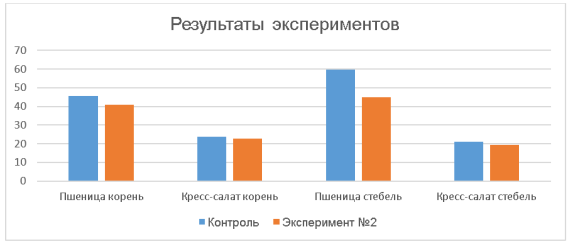
Рис. 1. Сравнение результатов контрольной группы и эксперимента № 2
Эксперимент № 3
Пшеница 60 Затон около реки Ока
Средняя длина корня пшеницы (э.2) Lср=(2096)/(56)=37,4
Средняя длина стебля пшеницы (э.2) Lср=(2630)/(56)=46,9
АЭЛИТА 60 Затон у реки Оки
Средняя длина стебля кресс-салата (э.2) Lср=(1287)/(58)=22,2
Средняя длина корня кресс-салат (э.2) Lср=(1371)/(58)=23,6
Результаты и выводы из эксперимента № 3
Растения чувствуют себя гораздо лучше при использовании вытяжки из почвы около реки. Их стебли и корни стали длиннее контрольных значений, кроме корней кресс-салата АЭЛИТА, они стали немного короче.
Исходя из всего вышеперечисленного, мы можем сделать следующий вывод:
Водная вытяжка, полученная из почвы, взятой около железнодорожных путей, немного загрязнена. Возможно тяжелыми металлами или мусором. Также возможны другие виды загрязнений. Водная вытяжка, полученная из почвы, взятой около затона реки Оки, не загрязнена. Потому что растения в этой почве чувствуют себя комфортно и либо достигают контрольных значений, либо становятся выше их.
Диаграмма, наглядно демонстрирующая различия полученных значений из всех экспериментов:
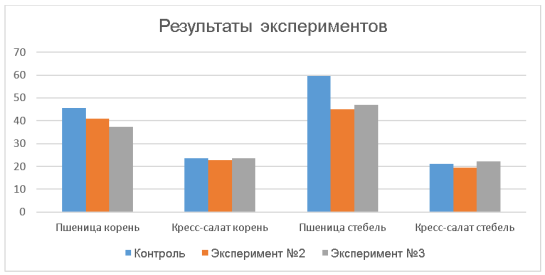
Рис. 2. Сравнение результатов всех проведенных экспериментов
Результаты и обсуждение
Влияние почвенных вытяжек на рост и развитие растений
Результаты проведенного исследования выявили статистически значимые различия (p < 0,05) в воздействии водных вытяжек, полученных из почвенных образцов, отобранных на различных участках Автозаводского района, на ростовые и морфологические характеристики растений-индикаторов.
Адаптационные реакции растений на воздействие почвенных вытяжек
В ходе эксперимента наблюдались адаптационные реакции растений на изменённые условия выращивания. В частности, выращивание пшеницы в водной вытяжке из почвы, взятой в непосредственной близости от железнодорожных путей, приводило к уменьшению длины корневой системы на 10 % по сравнению с контрольными образцами. В то же время водная вытяжка из почвы, отобранной вблизи затона реки Оки, оказывала стимулирующее воздействие на рост растений: зафиксировано увеличение средней высоты стебля кресс-салата и длины стебля пшеницы на 12 % и 10 % соответственно по сравнению с контрольными значениями. Этот факт позволяет предположить благоприятные экологические характеристики исследуемого участка.
Практическое значение результатов исследования
Результаты проведенных исследований будут иметь существенное практическое значение для формирования комплексных стратегий улучшения экологической ситуации в городах. Эти данные послужат базой для разработки современных методов мониторинга состояния почв и внедрения технологий, направленных на снижение уровня загрязнения. Кроме того, полученные результаты могут быть применены для оптимизации системы городского озеленения, включая выбор наиболее устойчивых к неблагоприятным факторам видов растений, что в конечном итоге способствует повышению общего качества городской среды.
Литература:
- Бекузарова С. А., Дзампаева М. В., Басаева Д. А. Фитоиндикаторы загрязненных почв // Актуальные проблемы и перспективы развития сельского хозяйства юга России. — Майкоп: Адыгейский научно-исследовательский институт сельского хозяйства, 2019. — С. 96–99.
- Русаков Н. В., Крятов И. А., Пиртахи Н. В., Тонкопий Н. И., Карцева Н. Ю., Стародубов а. г. Методические рекомендации мр 2.1.7.2297–07. обоснование класса опасности отходов производства и потребления по фитотоксичности 2.1.7. Почва. Очистка населенных мест. Бытовые и промышленные отходы. Санитарная охрана почвы // Экологический консалтинг. — 2008. — № 3 (31). — С. 11–16.
- Пыхалова С. В., Рыбина Г. Е. Оценка токсичности почв, отобранных с территории парковых зон с помощью ракообразных // Сборник трудов II Международной научно-практической конференции молодых ученых и специалистов. — Тюмень: Государственный аграрный университет Северного Зауралья, 2022. — С. 47–56.
- Котяк П. А. Оценка токсичности почв, отобранных с территории парковых зон с помощью ракообразных // Управление плодородием и улучшение агроэкологического состояния земель. — Ярославль: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ярославская государственная сельскохозяйственная академия», 2019. — С. 49–54.







